 发病机制
发病机制
发病机制:
1.类风湿关节炎发病机制的认识过程 类风湿关节炎发病机制的研究是一个漫长的过程,至今也没有得到明确的定论。回顾这一认识过程,可以更清楚地认识类风湿关节炎。
早在20世纪20年代,就有人提出感染可以导致RA,并且将RA作为感染性疾病进行治疗,尽管有一定的疗效,但是一直没有找到感染的致病微生物。在20世纪40年代,Waaler、Rose及其同事发现了类风湿因子,并将它与RA的出现联系在一起,以后陆续发现了B细胞、免疫复合物、补体等在RA发病中的作用。体液免疫的异常,被认为是RA发病中起关键作用的因素。这种思想统治了近40年。直至20世纪80年代,随着对细胞因子的认识逐渐深入,提出RA是由T细胞介导的自身免疫性疾病,在此基础上发展出许多针对T细胞的治疗方法,并取得了一定的疗效。但是与此同时,又发现了一些不支持T细胞在RA发病起主要作用的证据。20世纪后期,随着对RA滑膜细胞的认识逐渐深入,发现成纤维样滑膜细胞具有转化的特性,由此逐渐将固有免疫的作用提到了重要的位置。
对RA发病机制的认识过程,实际上也是对RA整个疾病的认识过程。随着生物技术的提高,研究手段的不断丰富,在21世纪,RA的发病机制必将取得突破性的成果。
2.滑膜组织的异常增生
(1)滑膜组织的结构:滑膜层位于关节囊的内层,分为滑膜内层和滑膜下层。滑膜内层,又称滑膜衬里层,是由疏松排列的细胞组成,它介于滑膜与滑液之间。该层有两种主要的细胞类型:巨噬样细胞(又称A型滑膜细胞)和成纤维样细胞(又称B型滑膜细胞)(表7)。
前者是由骨髓分化而来,表达巨噬细胞表面标记物,并高度表达HLA-DR;而后者缺乏特异的HLA-DR分子标记。在生理条件下这两种类型细胞的数量,前者占20%~30%,后者占70%~80%。滑膜内层的细胞之间缺乏紧密连接,而且与滑膜下层的细胞间没有基底膜相隔,这也为RA滑膜细胞的大量增生提供了结构基础。滑膜下层,又称滑膜衬里下层,主要由成纤维细胞、脂肪细胞、巨噬细胞、肥大细胞、胶原纤维和蛋白多糖组成,该层含有丰富的血管和淋巴管,主要对滑膜细胞起营养作用。
(2)类风湿关节炎滑膜组织的变化:正常人的关节滑膜内层仅1~2层细胞组成,而RA患者的滑膜内层通常有4~10层细胞(有时甚至超过20层)。这些细胞不仅在数量上异常增多,而且在功能上处于异常活跃的状态,它们可以分泌大量的细胞因子、信号分子和蛋白酶,加速关节破坏的进程。另外,RA滑膜中还有大量的炎性细胞浸润,如T细胞、B细胞和单核细胞,以及微血管数量的显著增加。
①滑膜中细胞的变化:巨噬细胞与巨噬样滑膜细胞:RA滑膜中浸润着大量的单核细胞。这些单核细胞来自骨髓,迁移至关节后被激活,并成为滑膜巨噬细胞。在它们迁移至滑膜的过程中,单核细胞吞噬外源性抗原,并将它们转送至关节腔内。归巢受体(homing receptors)和黏附因子表达于单核细胞和内皮细胞表面,引导单核细胞向内皮细胞转移。在关节中,巨噬细胞可以将吞噬消化的抗原递呈给记忆性T细胞,引发T细胞的活化。现在认为,炎性关节释放的细胞因子大部分源自巨噬细胞。包括肿瘤坏死因子a、IL-1和IL-6等,其数量远远超过T细胞自身分泌的细胞因子。
RA患者的两种滑膜细胞都出现明显的增加,不过以巨噬样细胞(A型滑膜细胞)增加为主。增加的巨噬样细胞也来自骨髓的单核/巨噬细胞,而非局部细胞增殖的结果。有研究者观察到,RA的滑膜细胞表达特异性的黏附因子如E-选择素、血管细胞黏附分子(vascular cell adhesion molecule,VCAM-1)和细胞间黏附分子(intercellular adhesion molecule,ICAM-1),故推测这些黏附因子通过与内皮细胞的相互作用使单核/巨噬细胞不断浸润进入滑膜组织。这种滑膜细胞主要集中于滑膜内层的表面,与滑液相接触。具有吞噬关节腔内碎屑的功能,而且这些细胞表面表达MHCⅡ类抗原和Fc受体,故可作为与T细胞相互作用的抗原递呈细胞。同时,它与巨噬细胞一样也可分泌大量的细胞因子,比如IL-1、IL-8、肿瘤坏死因子-α、TGF-β等,对促进关节的炎症起着重要的作用。
②成纤维样滑膜细胞:成纤维样滑膜细胞(又称B型滑膜细胞)主要来自间充质,紧邻滑膜下层,靠近软骨。它的表面几乎不表达特异性的MHCⅡ类抗原,缺乏巨噬细胞的标记物。不过,在某些增殖因子的作用下它可出现局部增殖。有研究认为,由其他类型细胞产生的细胞因子包括血小板生长因子(platelet-derived growth factor,PDGF)、肿瘤坏死因子-α和IL-1,与花生四烯酸的产物共同作用促进成纤维滑膜细胞的增殖。但是对这个假设有一点疑问,即在定量测定RA滑膜活化细胞的分化过程中,发现这些细胞几乎没有出现有丝分裂相,而且只有少数细胞摄取利用胸腺嘧啶。近来有研究显示,成纤维样滑膜细胞增殖的主要原因与以下一些因素相关:
A.与诸如早期生长反应基因-1(early growth response gene-1,egr-1)、c-myc和ras等增殖相关的原癌基因的激活有关。
B.RA滑膜衬里层大多数成纤维样滑膜细胞表达增殖细胞核抗原(proliferating-cell nuclear antigen,PCNA),研究表明这与成纤维样滑膜细胞表达的原癌基因c-myc有关,而后者在细胞增殖中有重要的作用。
C.与RA异常的细胞凋亡相关。据观察,RA成纤维样滑膜细胞在细胞的生长与死亡这两方面处于失衡状态。发现调节细胞凋亡的Fas蛋白和诸如c-myc、bcl-2、bcl-xl等,几种重要的调节细胞凋亡过程的原癌基因,以及肿瘤抑制基因p53都呈过度表达,结果造成无效的细胞凋亡,导致RA滑膜细胞的增殖。
D.滑膜细胞的增殖伴有成纤维样滑膜细胞出现转化的特征,特别是在受到侵蚀的骨与软骨交界处。目前认为,RA中成纤维样滑膜细胞的过度增生是造成滑膜增厚的主要原因。成纤维样滑膜细胞可以产生细胞因子、多种蛋白酶,对骨与软骨组织造成侵蚀,被认为是介导RA关节破坏的主要细胞。
③T细胞:在RA的滑膜中T细胞占30%~50%。它们可以聚集在血管周围形成的淋巴滤泡样结构中,也可以分散于血管周围的滑膜组织中。浸润于RA滑膜组织的T细胞主要为CD4 记忆性T细胞(CD45RO ),可高度表达IL-2受体和MHCⅡ类抗原以及黏附分子。大多数的研究发现RA滑膜组织中的T细胞为Th1细胞。在RA滑膜中浸润的T细胞只有少数为CD8 T细胞。
T细胞是如何进入滑膜组织的?研究表明,在T细胞黏附、活化和移行过程中,黏附分子、细胞因子和趋化因子起着重要作用。T细胞表面的L-选择素与内皮细胞的糖基化-依赖性细胞黏附分子-1(GlyCAM-1)结合,但两者的亲和力较低。随着T淋巴细胞在血管内缓慢移动,由巨噬细胞产生的肿瘤坏死因子-α、IL-1等细胞因子诱导T细胞产生极后期激活作用抗原(very late activation antigen,VLA)、淋巴细胞功能相关抗原(lymphocytic function-associated antigen,L
FA)等黏附分子,对T细胞产生不同程度的趋化作用。此后,通过内皮细胞的血管细胞黏附分子-1(VCAM-1)与T细胞表面VLA-4的相互作用使T细胞与内皮细胞发生黏附,而内皮细胞的细胞间黏附分子(ICAM-1)则通过与T细胞表面的L
FA-1结合促使T细胞移出血管外。内皮细胞的黏附因子与体内循环的T细胞表面相应的黏附因子以“受体-配体”的方式结合,使之黏附于内皮细胞上移行至血管外。被炎症反应活化的滑膜细胞同时也分泌IL-8、RANTES等趋化因子,在它们的作用下T细胞向滑膜炎症反应部位移行。由此可以看出,T细胞浸润于滑膜组织这一过程是非抗原依赖性的,属于非抗原特异性的局部增殖。大量细胞黏附因子在患者滑膜组织的表达是吸引免疫细胞移动、浸润并存在于滑膜组织的中心因素,它们使得滑膜组织发生的炎症反应局限而持续。
④B细胞:RA的滑膜组织中B细胞的数量很少,占滑膜所有细胞的不足5%,主要集中于滤泡样结构中,在滤泡周围可以看到浆细胞和巨噬细胞。其中有的滤泡样结构形成生发中心(germinal centre),说明关节中存在淋巴组织样结构。生发中心是抗原激活的B细胞发展成为记忆性B细胞和浆细胞的微环境,也是体液免疫反应发生亲和性成熟(affinity maturation)的部位。通过显微解剖从RA患者冰冻的滑膜组织中可以直接分离得到增殖的B细胞。研究表明,在生发中心活化的B细胞,是依赖T细胞(dependent-T cell)的形式诱发克隆增殖的。在生发中心还有一种滤泡状树突状细胞(follicular dendritic cells,FDC),它是一种高度特异性的抗原递呈细胞。其表面可以表达补体和高亲和性Fc受体,对RA滑膜中B细胞反应的亲和性成熟有重要的作用。这些滤泡状树突状细胞可以在B细胞克隆性增殖中形成。
⑤树突状细胞:正常滑膜组织无树突状细胞(dendritic cell,DC),而RA滑膜和滑液中含有丰富的树突状细胞。这些树突状细胞来自外周循环中不成熟的前体。有研究推测,滑膜组织中常有来自轻微创伤、感染、过敏或局部免疫复合物形成等非特异性炎症反应,这些刺激导致滑膜衬里层的巨噬细胞释放细胞因子。在GM-CSF、肿瘤坏死因子α、IL-1等细胞因子的作用下,DC在滑膜组织中得以分化和成熟。在成熟的过程中,DC表达MHCⅡ类分子和刺激T细胞的辅助受体(coreceptors)。研究显示,在树突状细胞存在的情况下,极少量的超抗原即可有效地刺激T细胞引起免疫反应。
⑥其他细胞:尽管滑膜液中嗜中性粒细胞非常丰富,但是它在滑膜组织中的数量非常有限。自然杀伤细胞(natural killer,NK)也可在滑膜中找到,它可以刺激B细胞产生RF。
(3)滑膜组织中的细胞因子:
①细胞因子在RA滑膜病变中起着核心作用。细胞因子系统通过作用于多种细胞并相互调节形成一个复杂的网络。在RA的滑膜中,不仅T淋巴细胞可以分泌多种细胞因子,如IL-2、IFN-γ、IL-4等,而且巨噬样滑膜细胞和成纤维样滑膜细胞也可分泌多种细胞因子,例如肿瘤坏死因子-α、IL-1、IL-12、IL-6、IL-15等。反之,这些细胞因子会刺激或抑制上述细胞进一步分泌细胞因子。
目前对RA细胞因子的研究发现,RA滑膜细胞产生的细胞因子呈稳定、持续的表达。体外试验表明,多种物质可刺激滑膜细胞产生细胞因子,而且,细胞因子本身也是产生细胞因子强有力的刺激因子。在T细胞的免疫应答下调后,滑膜中的巨噬细胞和滑膜成纤维细胞以旁分泌或自分泌方式产生的细胞因子使炎症反应得以延续。另外,在滑膜或滑液中可检测到多种细胞因子,它们不仅能够解释滑膜衬里层细胞增生的原因,而且能够诱导HLA-DR和黏附分子的表达,以及滑膜微血管的形成。
RA滑膜的炎症反应涉及的细胞因子种类非常多。研究表明肿瘤坏死因子-α和IL-1在RA的发病中起着极其关键的作用。这两种细胞因子刺激滑膜成纤维细胞增生,分泌IL-6、GM-GSF、趋化因子以及基质蛋白酶和前列腺素等效应分子。其中,GM-CSF是由滑膜巨噬样细胞和成纤维细胞共同分泌的,它不但可以诱导IL-1的分泌并形成一个正反馈环,而且还可与肿瘤坏死因子-α共同作用于巨噬细胞增加HLA-DR的表达。另外,由巨噬细胞和成纤维细胞分泌的细胞因子还可以间接作用于局部T细胞和B细胞的活化,其中包括RF的产生。
肿瘤坏死因子-α主要由滑膜衬里层的滑膜巨噬细胞产生。已证实肿瘤坏死因子-α作用的靶目标是某些抗肿瘤坏死因子-α成分(如可溶性肿瘤坏死因子-α受体等)。影响肿瘤坏死因子-α产生的因素包括免疫复合物、补体的活化、细胞外基质成分和局部细胞因子的表达。这里特别要提到局部细胞因子的表达。近来的研究表明,由滑膜细胞分泌的IL-15不仅可以促使T细胞的移位、活化以及趋化因子的产生,还能增加肿瘤坏死因子-α的产生。研究显示,不仅在RA滑膜内检测到了IL-15的mRNA和蛋白,而且,在体外实验观察到可溶性IL-15受体可以直接减少滑膜巨噬细胞产生肿瘤坏死因子-α,或者通过与IL-1、IL-6以及肿瘤坏死因子-α共同促进T细胞/巨噬细胞间的相互作用。
②研究表明,肿瘤坏死因子-α被认为是滑膜炎症反应的关键性细胞因子,可能的证据是:
A.肿瘤坏死因子-α的生物活性直接或间接参与RA多种病理过程,包括炎性细胞的聚集和激活、滑膜细胞的增殖、诱导成纤维滑膜细胞产生骨和软骨破坏的细胞因子和蛋白酶、刺激巨噬细胞产生其他细胞因子等(图3)。
B.在RA滑膜组织中肿瘤坏死因子-α和肿瘤坏死因子-α受体明显升高。
C.在体外,抗肿瘤坏死因子-α抗体对IL-1及其他,前炎性细胞因子的产生有抑制作用。
D.过分表达肿瘤坏死因子-α的转基因小鼠产生侵蚀性关节炎,其组织学特点与RA类似。
E.关节炎的动物模型证实,抗肿瘤坏死因子-α物质可以减轻病变程度。
F.对RA予抗肿瘤坏死因子-α治疗可以产生较好的临床效果。最近的研究显示,虽然给予抗肿瘤坏死因子-α治疗可以有效地控制病情,但一旦停药疾病即复发,而且抗肿瘤坏死因子-α治疗并不是对所有的患者都有效。因此,有研究者观察到,RA持续存在的滑膜炎症并不是由产生肿瘤坏死因子-α的自分泌反馈环所造成的,还有其他重要因素的参与。因此,今后的研究需要进一步探讨肿瘤坏死因子-α在炎症细胞因子中是否具有独特的地位等问题。
IL-1也是滑膜炎症反应的关键性细胞因子。在RA滑膜中,它也是由滑膜巨噬细胞产生的。多种因素可以诱导IL-1的产生,例如,免疫球蛋白的Fc段、免疫复合物、胶原片段以及T细胞的信号分子等。在滑膜中,IL-1可以诱导成纤维细胞的增生,刺激滑膜细胞合成IL-6和GM-CSF,并可增加成纤维细胞产生胶原酶。另外,它还可以刺激滑膜细胞增加与细胞相连的或细胞外的纤溶酶原激活剂的活性。现已证明,IL-1β是一种刺激骨骼吸收的破骨细胞的活化因子。IL-1还可刺激内皮细胞分泌黏附因子,包括VCAM-1和ICAM-1。RA的动物模型显示IL-1是调节骨与软骨破坏的重要的细胞因子。
③T淋巴细胞作为RA滑膜中数量最多的一类炎性细胞,而在滑液中,很少能检测到T淋巴细胞分泌的细胞因子,并且疾病的发生和发展并不会造成T细胞分泌的细胞因子发生变化。例如,无论在RA早期还是活动期IFN-γ在关节内表达的数量基本不变。为什么RA滑膜中T淋巴细胞分泌的细胞因子数量如此之少呢?可能有以下一些原因:
A.细胞活性受到局部抑制是造成T细胞免疫应答能力下降的原因之一。例如,在RA滑液中可检测到IL-1受体拮抗剂(IL-1Ra)和TGF-β这两种T细胞的抑制剂。另外,滑液中某些非特异性成分如hualuronate,也可以间接抑制T细胞的活性。在RA患者滑膜组织的微环境中,由巨噬细胞分泌的肿瘤坏死因子-α和由滑膜组织细胞分泌的IL-10均可下调T淋巴细胞的功能。
B.与T细胞受体(TCR)信号异常相关。特别是经p38有丝分裂原活化的蛋白激酶(MAPK)信号转导途径的刺激,滑液中T细胞可以减少酪氨酸的磷酸化。而且,TCRζ链的酪氨酸磷酸化也存在异常,研究发现TCRζ链的水平下降,这表明RA中有TCR装配异常。
C.与T细胞功能的抑制剂存在缺陷有关。体外实验观察到,RA中IFN-γ的产生明显受到抑制,但是,当加入吲哚美辛后这种情况可被纠正。有研究显示,T细胞产生IFN-γ的减少是因为RA细胞对PGE反应的敏感性增加。而且实验证明,来自RA病人外周血的T细胞产生IL-2减少,当加入吲哚美辛后上述这种情况也可得到部分改变,这也进一步说明RA病人对PGE有更高的敏感性。
D.可能是这些细胞因子在滑膜中以微量的形式就足以维持疾病病理变化的持续进行。不过,RA滑液中T细胞分泌的IFN-γ作用很重要。它是MHCⅡ类抗原最有效的诱导剂,可以激活单核巨噬细胞,还能诱导VCAM-1和ICAM-1等黏附因子在内皮细胞的表达,并且能够协助招募炎性细胞向损伤部位聚集。另外一个重要的作用就是IFN-γ可以改变细胞外基质的合成与降解之间的平衡。总之,目前对T细胞分泌的细胞因子其准确的功能还知之甚少。
④在RA滑膜炎症反应的过程中,滑膜内的细胞还释放各种具有抗炎症的细胞因子,例如IL-1受体的拮抗剂、可溶性肿瘤坏死因子-α p75和p55受体、可溶性IL-1受体、IL-16、IL-11、IL-13和IL-10等。在RA炎症反应的调节过程中,这些抗炎症细胞因子的表达也有所增加,但仍不足以抑制关节滑膜炎症的发生。研究发现,细胞表面脱落的可溶性肿瘤坏死因子受体p55和p75是在关节滑膜液中可检测到的两种受体,但其浓度不足以中和关节滑膜液中产生的内源性肿瘤坏死因子;与此相似,IL-1受体拮抗剂是IL-1的天然抑制剂,在许多RA患者滑膜液中表达的水平也较高,同样也不足以消除IL-1引起的炎性作用。目前的研究认为,促炎症性细胞因子和抗炎性细胞因子之间作用的失衡使细胞因子的内稳定遭到破坏,这是RA发病的重要特征。利用这些细胞因子无疑对RA的治疗很有价值。近年来,运用基因重组技术已研制出多种细胞因子的拮抗剂,并取得了令人满意的临床疗效。
(4)滑膜中信号分子的作用:通过各种刺激,细胞内信号转导系统将细胞表面已启动的细胞外信号转入核内,并在此整合转录因子的水平。转录因子结合特异的DNA位点,调节某些适当基因的表达。RA滑膜组织的异常增生与炎症反应相关,越来越多的证据表明有多种转录因子参与了这一过程。核因子κB(nuclear factor-κB,NF-κB)、激活因子蛋白-1(activator protein-1,AP-1)和分裂素激活的蛋白激酶(mitogen-activated protein kinase,MAPK)被认为在RA中起重要的作用。
①核因子-κB:NF-κB是一种普遍存在的转录因子,在RA基因转录中有着十分广泛且重要的作用,此外在调节诸如单核细胞的IL-1β,内皮细胞的E-选择素、VCAM-1、JCAM-1,以及滑膜细胞的肿瘤坏死因子-α、IL-6、MMP-1等炎症因子中也发挥着重要的作用。典型的NF-κB是由p50(NF-κBl)和p65(RelA)组成的二聚体,它还包括p52(NF-κB2)、Re1B和c-Rel等成分。
多种不同的信号可以激活NF-κB,例如,肿瘤坏死因子-α、IL-1、离子化射线、脂多糖和过氧化氢。在胞质内NF-κB与被称作NF-κB抑制剂(IκB)的抑制性蛋白相连呈无活性状态。在IκB家族中还有IκBa、IκBβ和IκBε,它们通过遮盖胞核定位信号以调节DNA的结合和亚细胞NF-κB蛋白的定位。胞外的刺激可启动信号级联反应,并导致两种IκB激酶(IKKs,包括IKK-1、IKK-2)的活化。这两种激酶可引起IκB氨基端的丝氨酸残基磷酸化。这一过程使NF-κB移位至细胞核,在此它可以结合靶基因启动转录。
NF-κB在RA滑膜中的含量十分丰富。免疫组化分析证明,在滑膜衬里层和血管内皮的细胞核中存在p50和p65 NF-κB蛋白。实际上,NF-κB介导许多来自巨噬细胞的炎症介质的表达,包括肿瘤坏死因子-α。另外,在骨关节炎的滑膜中也有NF-κB的表达,但在正常人则没有。不过根据电泳迁移分析(electromobility shift assays),NF-κB在RA滑膜中的活性比在OA滑膜中的强。
当IKK激活后,经肿瘤坏死因子-α和IL-1等细胞因子的刺激,在培养的RA成纤维样滑膜细胞中很快发生NF-κB向胞核移位。两种IκB激酶(IKKs)在滑膜细胞中呈结构性表达,它们的功能由肿瘤坏死因子-α和IL-1诱导,其中IKK-2是滑膜细胞经细胞因子刺激后NF-κB活化的主要途径。
利用
腺病毒感染的方法使培养的RA滑膜出现IκBα过度表达,可以抑制肿瘤坏死因子 α、IL-1和IL-6的产生;在体内通过诱导寡核苷酸或蛋白酶抑制剂以抑制NF-κB的活性,可以减轻大鼠佐剂性关节炎的炎症。这些资料说明,活化的NF-κB是维持RA滑膜产生肿瘤坏死因子-α的重要因素,而且在体内将NF-κB,作为靶目标抑制其作用可以有效地抑制炎症。
在关节炎的动物模型中也可以观察到NF-κB表达的增加。例如当免疫大鼠出现佐剂性关节炎3天后,NF-κB即可在其滑膜细胞内出现活化,磷酸化IκB的抑制剂可以抑制关节炎的临床表现。在小鼠胶原性关节炎中,当给予第1次免疫后,10天内发生滑膜NF-κB的活化,这比临床出现关节炎的时间提早很多。另外,在链球菌细胞壁成分诱导的关节炎,滑膜组织中的NF-κB也可被激活,而且如果抑制NF-κB的活性,可以增加肿瘤坏死因子α和Fas介导的滑膜细胞的凋亡(后一小节会详细讲述)。关节中NF-κB的活化可以保护细胞不发生凋亡,从而导致滑膜组织的过度增殖。
②AP-1:与NF-κB一样,AP-1也可用于调节多种作用于RA的基因,包括肿瘤坏死因子α和金属蛋白酶。细胞因子、生长因子、肿瘤激动剂和Ras原癌蛋白等,细胞外信号可以诱导AP-1活化。AP-1包括Jun和Fos两种转录因子家族,它们具备亮氨酸拉链DNA结合结构域。AP-1蛋白以Jun同型二聚体或Jun-Fos杂二聚体的形式与DNA结合,并激活转录。在不同类型的细胞中表达多种Jun和Fos家族成员,如c-Jun、JunB、JunD、c-Fos、FosB、Fra-1、Fra-2等。它们介导独特和重叠基因的转录。
免疫组化的研究证明,在RA滑膜中有AP-1免疫反应性成分的表达,特别是在滑膜衬里层的成纤维样滑膜细胞中。在滑膜下层浸润的炎性细胞也表达c-Jun和c-Fos,只是数量较少。在正常滑膜组织中,尚未检测到AP-1,而在OA病人的滑膜中也检测到AP-1。不过,与NF-κB一样,根据电泳迁移分析(electromobility shift assays),AP-1在RA滑膜中的活性比在OA滑膜中的强。在RA滑膜中,AP-1的活性有可能与RA滑膜细胞暴露于IL-l和肿瘤坏死因子-α等多种炎性介质有关。
试验显示,培养的RA滑膜成纤维细胞经过几代细胞传代后处于静止期,AP-1的活性水平很低,而且仅仅表达很少量的Jun和fos基因。但是当给予IL-1或肿瘤坏死因子-α刺激后,c-Jun和c-Fos mRNA的合成上调,AP-1的活性以及胶原酶基因转录水平显著升高。现已明确,在滑膜细胞中构成AP-1特异的Jun基因家族的功能,例如c-Jun可增加炎症介质的产生,而JunD则可抑制细胞因子和金属蛋白酶的产生。
③有丝分裂原活化的蛋白激酶:有3种主要的有丝分裂原活化的蛋白激酶(MAPK)作为级联信号转导酶,包括细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、JunN端激酶(JunN-terminal kinase,JNK)和p38。它们主要调节c-Jun的磷酸化以及细胞因子的产生。ERK主要藉赖Ras途径通过分裂素使细胞因子和生长因子得以活化,JNK和p38则是在IL-l和肿瘤坏死因子α等细胞因子的刺激下产生活性,主要通过短暂地暴露于IL-1之后,经磷酸化产生活性。JNK在AP-1的调节中非常重要,因为它是磷酸化c-Jun的主要激酶家族。JNK存在JNKl、JNK2和JNK3 3种同工型。其中JNK2在RA滑膜细胞中呈结构性表达,JNK2与c-Jun结合产生的亲和力至少是JNK1的25倍,因此JNK2被认为是与成纤维样滑膜细胞中AP-1相关的激动剂。通过JNKs作用于c-Jun N端磷酸化至少可将c-Jun转录的水平提高30倍。另有研究证实,在敲除JNK1和JNK2的小鼠中,JNK对金属蛋白酶的表达有很重要的作用。
(5)滑膜中细胞凋亡的作用:近几年,人们逐渐认识到细胞凋亡在RA发病中的作用。细胞凋亡是细胞程序性死亡的一种。细胞凋亡存在于正常生理情况下,是在个体发育、多细胞生物体的平衡和疾病发生中起重要作用的一种细胞死亡形式。滑膜细胞的大量增殖和炎症细胞的侵入是RA的典型特征。目前的研究认为这与细胞周期(增殖/凋亡)的失调有关。
近来的文献报道显示,利用DNA电泳、电子显微镜和TUNEL(DNAnick-end labeling)方法检测到滑膜组织中存在凋亡细胞。不过,这种凋亡细胞数量很少,这主要由于它们位于巨噬细胞周围,一旦出现很快就被巨噬细胞所清除。目前识别出3种与细胞表面相关的受体,它们是Fas抗原(CD95)以及两种肿瘤坏死因子受体,后者分别是55kD的肿瘤坏死因子-RⅠ和75kD的肿瘤坏死因子-RⅡ,其中Fas抗原是一种45kD细胞表面蛋白,许多类型的细胞表达此种膜细胞死亡受体。它们都属于肿瘤坏死因子/神经生长因子受体家族,参与调节细胞的生存和死亡。Fas配体(Fas-ligand,Fas-L)是40kDⅡ型转膜蛋白质,主要表达于活化的T细胞表面。它可诱导诸如B和T淋巴细胞、巨噬细胞或嗜中性粒细胞等易感靶细胞的凋亡。
RA滑液中活化的T细胞表面表达大量的Fas分子。Fas与Fas-L的相互作用,能够启动细胞凋亡。当IL-1β和肿瘤坏死因子-α占据各自细胞表面的受体时,它们也可通过这种机制引发细胞的死亡。研究发现,RA滑膜组织既含有Fas 的滑膜细胞和单核细胞,也含有表达Fas-L的活性T细胞和自然杀伤细胞。因此,在RA滑膜中,通过Fas/Fas-L的相互作用激活受体介导的滑膜细胞凋亡,这在细胞凋亡中起关键性作用。表达Fas-L的T细胞或自然杀伤细胞与滑膜细胞和单核细胞表面的受体Fas相互作用,也许在RA细胞增殖的自然缓解期起一定作用。反之,在RA细胞增殖阶段,Fas/Fas-L的相互作用有可能受到其他因素的影响或破坏。细胞内的蛋白Bcl-2家族有抑制或增强细胞凋亡的作用。CD4 CD28-T细胞Bcl-2的表达增加可使细胞凋亡受到抑制,因此造成滑膜组织中自身反应性细胞的克隆增殖。
试验表明,不仅RA的滑膜细胞表达Fas分子,而且骨关节炎的滑膜细胞表面也表达Fas。但是,抗Fas抗体可以诱导RA滑膜细胞出现凋亡,而无法诱导OA出现凋亡。而且Fas刺激某些细胞可以出现增殖,而不是凋亡。这说明Fas还可以通过其他因素调节滑膜细胞的增殖或凋亡。这些因素包括细胞内信号转导途径和抗凋亡因子。近来的研究表明,NF-κB、AP-1、MAP激酶等信号转导途径参与了这一过程。有文献认为,理解RA滑膜细胞中Fas和肿瘤坏死因子-α介导的信号途径非常重要,这些因子能激活其信号分子如转录因子NF-κB,由此诱导凋亡抑制基因Bcl-xL和Survivin的表达,刺激滑膜细胞的增殖,并抑制成纤维细胞的凋亡。有研究表明,Fas无法激活NF-κB,但可以介导由JNK(属于MAP激酶)/AP-1诱导的凋亡;由肿瘤坏死因子-α激活的NF-κB在滑膜细胞增殖的调节中起着重要的作用。因此认为,NF-κB的调节作用在滑膜细胞的增殖或诱导其凋亡等方面都有很重要的作用。
还有一种因素对细胞凋亡产生影响,即肿瘤抑制基因p53。另外,它还是细胞周期、DNA复制、细胞分化和DNA修复等重要的调节剂。虽然p53本身不是原癌基因,但是它在c-myc等原癌基因的转录调控下,为诱导细胞周期停滞和细胞凋亡提供了重要的信号。在氧化应激的作用下,活性氧和活性氮的产生增加,造成DNA的损伤,使p53水平升高。功能性p53可以诱导细胞周期停滞、DNA修复或细胞凋亡。但是突变的p53可持续造成DNA的损伤,出现细胞转化而不出现细胞凋亡。研究发现,在RA的滑膜衬里层和衬里下层发现突变的p53,而且它的表达明显升高。故认为,p53对RA滑膜细胞的增殖也有一定的作用。
总之,在RA存在很多抑制细胞凋亡的因素,这也是引发滑膜细胞增殖和炎症细胞侵入的重要因素。
(6)新生的微血管:目前已认识到新生的微血管在炎症反应过程中起着极为积极的作用。它不仅可以作为机体选择细胞进入炎症组织的一种手段,而且还是促进组织生长和补充组织营养的决定因素。
在RA滑膜组织中可以看到大量新生的微血管,类似于肿瘤组织和创口愈合组织中所看到的。在多年以前就已有研究者发现了这一现象,并指出新生的微血管在滑膜炎症发展过程中的重要性。此后在胶原性关节炎的动物模型中证实了这一结论。而且研究表明,如果阻断炎症过程中血管的形成,那么可以缓解RA的病情发展。因此,RA中新生的微血管是炎症发生和发展过程中的基本条件,因为这些血管不仅可以用以招募炎性细胞,还可为增殖的滑膜组织提供营养物质。
RA滑膜的新生微血管数量明显增加,主要为毛细血管极高柱状内皮的毛细血管后微静脉。后者常位于淋巴滤泡中心。细胞间连接松弛和基底膜的不完整状态造成新生血管的通透性升高,为参与炎症反应的成分持续进入病变组织提供了结构基础,有利于维持并促进炎症反应的进行。
滑膜炎表现为大量的滑膜组织增殖,虽然伴有新生的血管形成,但从滑膜组织单位面积的分配上,这种新生血管的数量远远不能满足滑膜的需要。而且,研究显示RA滑膜的耗氧量是正常的20倍。这种局势必然造成局部滑膜组织出现缺血缺氧。另外,随着炎症的发展,关节腔内滑液逐渐增多,腔内压力也随之升高,都可造成血流减慢,滑膜组织缺氧。
滑膜组织的低氧状态是血管形成有效的刺激因素。新生血管形成的机制之一就是产生诸如血管内皮生长因子(vascular endothelial growth factor,VEGF)等血管形成因子。VEGF能增强局部血管的通透性,刺激内皮细胞进行有丝分裂,是一种特异性的促内皮细胞分裂因子,同时伴有某些趋化的特性。不仅在RA病变关节的积液中可以检测到高浓度的VEGF,而且在滑膜组织的血管内及其周围也可检测到。另外,VEGF的受体也存在于上述同一区域内。VEGF在滑膜衬里层呈高表达,培养的成纤维样滑膜细胞暴露于低氧环境和有IL-1存在的条件下,也可以产生VEGF。
除了低氧状态能够刺激RA滑膜新生微血管形成外,包括IL-8、成纤维细胞生长因子(fibroblast growth factor,FGF)和肿瘤坏死因子-α等在内的炎性细胞因子均被证明能刺激和参与血管新生过程。其他一些血管形成因子包括可溶性E-选择素和可溶性VCAM,也刺激新生血管的形成。
3.自身免疫的异常
(1)T细胞在类风湿关节炎中的作用:
有关T细胞在RA发病机制作用的假说:几十年来,围绕T细胞在RA发病机制的作用提出过多种假说。最初被多数研究者认同的,即认为RA是在遗传和环境因素的作用下由T淋巴细胞介导的自身免疫性疾病,因为有很多证据表明T细胞在RA发病中起着重要的作用:
①RA滑膜组织中浸润的细胞以单核细胞为主,其中30%~50%是T淋巴细胞。
②这些T细胞的绝大部分表达活化标记分子。
③针对T细胞的免疫治疗对RA有一定的疗效,这种疗法主要能够部分消除或抑制T细胞的活性。例如,用全身淋巴放疗或环孢素A治疗可以使病情得到缓解。
④在胶原性关节炎和佐剂性关节炎等动物关节炎模型中,自身反应性T细胞可以使患病动物出现疾病的转移。不过,还有一些重要的问题尚未解决,包括:
A.滑膜T淋巴细胞是否是病程进展的诱发因子。
B.T细胞浸润滑膜是否是关节内炎症反应的结果。
C.参与T细胞活化的自身抗原尚未找到。
近几年又提出一种新的假说,即在疾病发展过程中,存在外周免疫耐受机制的异常、淋巴细胞的异常增殖和T细胞内环境稳态的失衡。研究资料显示,在RA中,T细胞免疫的失调不仅仅局限于炎症反应的部位,更确切地说,在T细胞免疫耐受出现缺陷的基础上,滑膜形成具有慢性破坏性的淋巴组织。对动物模型的研究提示,这些自身反应性T细胞的增殖源自调控淋巴细胞增殖和T细胞内环境稳态的机制出现异常。
(2)RA滑膜中T细胞的特点:RA滑膜中的CD4 T细胞有以下一些重要的特点:
①表达CD45RO的同工型,使它们具有记忆细胞的特点,表明曾与抗原接触过。滑膜中naive T细胞数量非常少。在这个方面,滑膜与诸如淋巴结等周围淋巴组织不同。
②滑膜CD4 T细胞表达CD69,后者是一种早期活化的标志分子。RA患者的外周血T细胞很少表达这类分子。据文献报道,滑膜T细胞表达的CD69与疾病的严重程度相关,这也提示CD69 T细胞在疾病中的作用。
③现已明确,只有在两种信号的参与下抗原刺激的T细胞才能获得最大的活性,这两种信号分别是TCR-肽-MHCⅡ复合物和共刺激分子(co-stimulatory molecule),后者包括T细胞表面表达的CD28和CTLA-4以及APC表面表达的B7-1(CD80)和B7-2(CD86)。RA滑膜内的T细胞也表达CD28和CTLA-4,而且在关节内的APC也可见其配体B7。CD80和CD86与CD28或CT-LA-4结合,主要参与辅助刺激T细胞的活化,引起T细胞的增殖以及IL-2的分泌。不过,在RA血液和关节内检测到CD28-T细胞,这些细胞可与自身抗原产生应答,而且可以逃脱外周的免疫耐受。近来的研究表明,CTLA-4随着T细胞的活化出现上调,可以传递抑制信号而下调T细胞的增殖。CD40是另一种共刺激分子,表达于多种类型细胞的表面,包括B细胞、单核细胞/巨噬细胞、内皮细胞和成纤维样滑膜细胞。CD40的配体被称为gp39、CD40L或CD154,位于有活性的T细胞表面。在RA滑膜中可检测到CD40及其配体CD40L。特别是在IFN-γ存在的情况下,CD40与其配体之间的反应可以辅助刺激T细胞的活化、上调黏附分子、产生细胞因子和趋化因子、同型免疫球蛋白的转型以及产生一氧化氮。CD40的配体还可以诱导单核细胞的活化和树突状细胞的分化,以上这些都会影响RA的发展。如果缺少这些共刺激分子,T细胞将不会被激活,则会导致抗原识别的免疫耐受(tolerance)。
④聚集于滑膜的记忆性T细胞在功能上有一定的缺陷。滑膜T细胞表达的表型提示细胞凋亡存在异常(呈低Bcl-2和高Bax和Fas配体的表达),而且,滑膜T细胞的死亡率很低。相反,如果将这些滑膜中的T细胞分离出来,其生存率并不高。因此说明滑膜可以通过某些特殊的功能抑制细胞凋亡和促进细胞存活(表8)。
(3)RA中T细胞的作用:目前认为,T细胞在疾病的早期起着非常重要的作用。下面的这一假设可以解释T细胞是如何在RA中起作用的。首先,naive T细胞离开胸腺后,在外周循环中被激活,它们的表面表达活化标记物,并逐渐增强与内皮细胞黏附的能力,随后进入病变的关节内。如果没有持续的抗原作为刺激,T细胞表面表达的IL-2受体将逐步减少,一部分T细胞转变为记忆性T细胞。当关节内一小部分的记忆性T细胞识别出表达于抗原递呈细胞(APC)表面与MHC分子结合的抗原肽之后,T细胞被激活。其中滑膜细胞、巨噬细胞、树突状细胞和B细胞等APC表面都可携带MHCⅡ类分子,而MHCⅡ类分子可以与某种抗原肽相结合,并通过APC递呈给T细胞,与T细胞表面的TCR结合。这些浸润于滑膜组织的T淋巴细胞,通过与抗原递呈细胞上的“未知抗原”相结合,激起一系列免疫炎症反应,并分泌IFN-γ、IL-17、IL-2等多种细胞因子。
如前所述,根据光学显微镜和免疫组化的研究显示,浸润于RA滑膜组织的T细胞主要为CD4 记忆性T细胞(CD45RO )。CD4 T辅助细胞又可根据它们分泌细胞因子的种类分为两个亚型,即Th1和Th2。前者可产生包括IFN-γ、IL-2和IL-17等在内的促炎症性细胞因子,主要介导迟发型超敏反应,后者则可产生包括IL-4、IL-5、IL-10和TGF-β等在内的抗炎性细胞因子,主要参与变态反应以及抗体的活化和转型。在滑液中,很少能检测到T淋巴细胞分泌的细胞因子。近几年,有研究者利用RT-PCR或原位杂交技术发现,RA滑膜中以Th1细胞因子为主,而Th2细胞因子的水平极低。现尚不清楚T细胞分泌的细胞因子在RA发病中的作用。不过,近来的研究发现,滑膜T淋巴细胞分泌的IL-17是一种重要的细胞因子,尽管它的含量很低。它与IL-1和肿瘤坏死因子-α的许多作用相似,可以增强成纤维滑膜细胞产生胶原酶和其他细胞因子。更重要的是,RA滑膜组织中的IL-17可以协同IL-1和肿瘤坏死因子α激活滑膜细胞,增强局部的炎症反应。
正如前面所述,浸润滑膜的T细胞产生的细胞因子在滑液中的含量很低,那么,T细胞是如何来激活巨噬细胞的呢?滑膜内的各种细胞主要通过细胞因子的作用产生相互作用,也可以通过细胞直接接触的方式产生作用。最新的研究结果显示,患者滑膜组织中巨噬细胞的活化主要可能源自于巨噬细胞和T淋巴细胞之间的直接接触。CD4 T细胞浸润滑膜组织后直接和巨噬细胞接触,引起巨噬细胞的活化。活化的巨噬细胞分泌产生肿瘤坏死因子-α和IL-1等促炎症性细胞因子,同时也分泌产生IL-15,后者可促进由T细胞和巨噬细胞之间接触引起的巨噬细胞活化,而且它还能刺激T细胞,致使更多的T细胞得以活化。随着巨噬细胞的进一步活化,还会产生更多的肿瘤坏死因子-α和IL-1。近来的研究表明,T细胞与成纤维样滑膜细胞之间也存在细胞的直接接触,引起成纤维样滑膜细胞的进一步活化,分泌细胞因子和蛋白酶。值得注意的是,T细胞与滑膜细胞的直接接触并不需要活化的T淋巴细胞参与,说明这种反应可以通过非抗原依赖的方式完成。
近几年研究发现,RA滑膜组织形成具有淋巴结某些特征的异位淋巴组织,T细胞在这一形成过程中起着极其重要的作用。许多资料表明,淋巴样器官形成可以发生在诸如滑膜等淋巴外组织中。浸润于滑膜组织的淋巴细胞形成的滤泡样结构主要由CD4 T细胞和B细胞以及滤泡间的CD8 T细胞组成。在一些RA患者的滑膜滤泡样结构中发现有生发中心形成,说明关节中存在淋巴结样结构。生发中心的形成需要抗原特异性T细胞和B细胞之间的相互作用,以及通过共刺激分子表达的,且与T细胞和B细胞表面抗原特异性受体紧密相关的信号。现已证明这种生发中心的形成(一种介导抗原的收集和获得性免疫应答的复杂淋巴微型结构)是赖T细胞的,因为有证据表明,位于滑膜滤泡样结构中的B细胞产生的抗体有明显亲和性成熟的表现。推测滑膜组织中这种淋巴样器官的形成可能是免疫应答的结果(表9)。
总之,滑膜中活化的T细胞可以通过产生或诱导某些介质,调节巨噬细胞、滑膜细胞和B细胞的功能,加重RA滑膜的炎症。
(4)RA滑膜中T细胞的克隆增殖:关于RA滑膜T细胞是由少数几个T细胞克隆增殖而来,还是由多克隆激活的结果这一问题,目前还有争论。T细胞经活化后可出现克隆增殖。因为滑膜中T细胞的活化导致T细胞受体(TCR)成分的改变,故研究TCR成分可以更好地理解T细胞活化的性质。不过有关对滑液和滑膜组织中TCR Vα和Vβ基因片段出现的频率的研究得到矛盾的结论,这是由于研究该问题的方法不同而造成的。有的结论认为,如果超抗原参与了T细胞的活化或由于某种抗原特异性反应导致一组相关的T细胞增殖,那么增殖的T细胞有可能分享同一特殊的Vβ成分。但是,也有人持不同的意见,即RA T细胞源自许多不相关的克隆。因为大多数的研究表明TCR的成分确实有所改变,但这些改变并不明显,而且并不是所有的研究中都发现了这种改变。多项研究显示TCR Vα和Vβ的成分存在多样性。滑膜组织T细胞的分析表明,某些T细胞呈克隆增殖,但是,根据TCR的结构,这些T细胞的成分又是不同的。对这些观察最为合理的解释是,滑膜组织中只有一小部分T细胞的增殖是源自对抗原的免疫应答。增殖的T细胞表现出多样性,这也说明病变部位识别的抗原谱很广。
目前关于T细胞克隆增殖主要有两种结论,它们是:①T细胞的克隆局限于关节内,表现为对局部抗原的反应;②T细胞的克隆,呈非限制性分布方式,说明在保持T细胞多样性方面存在普遍缺陷。因此说,T细胞克隆增殖的反应可能是多种多样的,并不仅仅针对一个(或一些)引发疾病的T细胞克隆,这也可能是造成疾病异质性的原因。
(5)B细胞在类风湿关节炎中的作用:
①RA中的B细胞:RA中T细胞和B细胞的作用尚未全部被了解。很多研究者将自身免疫性疾病的研究重点放在T细胞的作用上。由于目前尚无确凿的证据显示RA中的自身抗体直接参与组织的损害,从而忽视了抗原一抗体复合物在疾病中的重要作用。大多数RA患者都可检测到自身抗体,而且有60%~80%的病人存在高亲和力的自身抗体。例如,类风湿因子就是对自身IgG恒定区产生的自身抗体。从对RF的研究发现,关节中形成的免疫复合物以及该免疫复合物对补体系统的激活,都可造成关节的破坏。B细胞除了产生抗体外,活化的B细胞还可识别抗原,而且它向T细胞递呈抗原的能力优于巨噬细胞,所以B细胞还是一类重要的抗原递呈细胞。
②正常的滑膜组织是无细胞结构的,而RA的滑膜中可以看到大量单核细胞的浸润。除了巨噬细胞,30%RA患者的滑膜发现了由T细胞和B细胞形成的滤泡样结构,其中有的形成生发中心(germinal centre),说明关节中存在淋巴组织样结构。细胞因子对这种异位淋巴组织的形成起着关键的作用。生发中心是抗原激活的B细胞发展成为记忆性B细胞和浆细胞的微环境,也是体液免疫反应发生亲和性成熟的部位。与从人扁桃体分离出的生发中心细胞一样,滑膜组织生发中心的B细胞表达低水平的CD38,并能够下调免疫球蛋白受体。在生发中心活化的B细胞依赖T细胞的形式诱发克隆增殖。研究显示,通过显微解剖从RA患者冰冻的滑膜组织中可以直接分离得到增殖的B细胞。
③活化的B细胞既可存在于外周血中,也可出现于滑膜组织中。细胞因子在抗体的产生和转型中起着非常重要的作用。IL-2在诱导所有同型免疫球蛋白中起主导作用。因为在缺少IL-2的情况下,没有其他细胞能够影响淋巴细胞的活化、增殖或分化。IL-4对B细胞有促进生长的作用,并可诱导MHCⅡ类抗原在B细胞表面的表达。
④目前已提出不少有关IgG何以具有免疫原性的假说。
A.当Ig分子聚集形成聚合物后或IgG与特异性非IgG抗原形成复合物,有可能暴露出新的IgG抗原决定簇。
B.RA患者IgG结构的异常可使IgG产生免疫性。例如,IgG铰链区的缺陷可能增加与B细胞膜上Fc受体结合的亲和力。另外,T细胞抑制剂的缺失可使得B细胞产生抗IgG的抗原决定簇抗体。
C.IgG自身抗原的活性与IgG糖基化结构的改变相关。例如,半乳糖基转移酶活性的异常可能会增加RA发生的危险性。
自身或非自身抗原产生的免疫应答是RA产生或持续存在的原因这一假设得到许多研究者的支持。作为体液免疫反应的效应细胞,B细胞在RA的发病中起着重要的作用。
⑤临床观察到的一些现象与抗原作为RA的病因这一结论相符:
A.一小部分RA患者在经历了几个月的活动期后会进入一段相当长的临床缓解期,这提示患者可能接触过某种抗原,但这种抗原随后被清除。
B.随着多关节病变的进展,约20%RA患者出现某一关节症状的发作,提示对局部抗原存在持续的免疫应答。
C.感染细小病毒B19、EB病毒、B型肝炎病毒或其他致病菌可引发类似RA的自限性关节炎。
D.发生胃肠道或泌尿生殖器的感染后可出现慢性关节炎(
反应性关节炎)。
有确凿的证据表明许多抗原参与了RA的发病,但同时也有一些相反的结论。造成这种现象的原因很多,包括研究对象在遗传、种族或人种方面的差异,社会经济的差异,疾病持续时间的长短,以及接受治疗的方法不同等,而且,检测抗原的方法也是多样的。下面将对RA出现的主要抗体分别进行介绍。
(6)类风湿因子:针对IgG的Fc段产生的特异性自身抗体是RA一个重要的免疫异常表现。对RA来说,类风湿因子(RF)并不具备特异性,因为在健康人和诸如慢性细菌性感染、器官移植和某些慢性炎性疾病等患者中也可出现。而且,RF出现的频率随年龄的增长而增高。大约80%RA患者的血清中可以检测到RF。尽管有诸多的限制条件,目前仍然将RF作为诊断RA的主要实验室指标。
多年的研究表明,有许多证据支持RF在RA的发病中有着重要的作用,它们是:①RA的严重程度和疾病的活动性与RF的水平相关。血清阳性的RA患者较血清阴性的RA患者出现关节外症状的频率更高(如类风湿结节、血管炎等),而且前者的血沉增快,补体水平升高,侵犯的关节数目增多;②滑膜是RA炎症反应主要发生的部位,它可以局部产生RF;③RF是血清、滑液、滑膜组织和软骨组织中免疫复合物的主要成分;④多克隆IgM RF可以通过经典途径固定和激活补体;⑤向RA患者的关节内注射RF可以促进炎症反应;⑥血清RF阳性的无关节症状者出现RA的危险性明显增加。
尽管有证据表明抗原介导的反应可以作为RF的调节剂,但是启动RF产生的机制尚不清楚。尚无证据显示免疫球蛋白基因是诱导RF产生的遗传危险因素。源自B细胞的肿瘤常可分泌带有限制性Vκ基因片段的RF;而用来形成类风湿关节炎RF的免疫球蛋白V基因片段的所有组成成分并不是惟一的,因为位于免疫球蛋白重链和轻链中的许多不同片段都可作为RF所有组成成分的代表,即RF包含一整套异质性胚系基因(germinal gene)成分。这似乎看来RA滑膜和外周血中产生RF的B细胞是抗原驱动反应的结果,而不是多克隆B细胞刺激的结果。目前尚不清楚遗传因素和外源性因素在促进多克隆B细胞活化过程中的作用。
在动物实验中可以看到,lpr小鼠的fas凋亡基因突变后可以产生高滴度的RF。包括凝集素和超抗原在内的多克隆刺激剂可以诱导RF的产生。如果将B细胞置于成纤维样滑膜细胞和IL-10的条件下进行培养,RF的产生明显增加。体外实验显示,在T细胞的作用下,RF可以发生同型转换和亲和性成熟。另外,RF阳性的B细胞增殖多发生于滑膜组织,因为这里是RF产生的部位。
RA患者的血清中出现RF,说明机体失去了免疫耐受。许多研究者对RF转基因小鼠的B细胞免疫耐受的调节进行了研究,并证实了上述现象。
在疾病的发展过程中,RF有以下一些作用:①含有RF的免疫复合物沉积于多种组织中,有可能通过参与滑膜组织和RA血管炎的炎症反应,激活补体级联反应,参与免疫损伤;②RF在RA中的作用与它正常的生物学功能密切相关,由于RF能够与IgG结合,使得表达RF的B细胞可以捕获由免疫复合物获得的抗原。与抗原特异性B细胞一样,RA中产生RF的B细胞可以作为IgG-抗原复合物的抗原递呈细胞,将免疫复合物含有的抗原递呈给抗原特异性Th细胞,以维持局部免疫应答,并刺激前炎症性细胞因子的产生;③IgG-RF可以进行自我识别,在一定的浓度下,可以形成二聚体和小的多聚体。有实验支持,这些复合物与CD16A(巨噬细胞上低亲和力的Fcγ受体)的结合可能是启动和促进慢性炎症的重要机制;④在对RA患者进行的试验中,将取自患者的RF注入一个关节,而将正常的IgG注入另一个关节,结果前者出现剧烈的炎症反应,后者则未出现。而且动物模型也证实了单独注入针对某一自身抗原的自身抗体可以引起疾病的转移。研究表明,该模型致病性的自身抗体对葡萄糖-6-磷酸异构酶有特异性。葡萄糖-6-磷酸异构酶是糖酵解途径中的一种酶,机体每个细胞都可表达该酶。但尚不清楚具有这种特异性的自身抗体是如何诱导关节炎症的。值得注意的是,这些结论来自对动物关节炎模型的观察。尚无直接证据显示人类RA产生的RF具备上述作用。
(7)RA的其他自身抗体:
①抗热休克蛋白dnaJ抗体:E.coli是热休克蛋白hsp65的成员之一,后者在DNA复制过程中起一定作用。细菌中的热休克蛋白通过分子模拟对启动类风湿关节炎B细胞的免疫应答有重要作用。推测认为,如果外源性抗原的序列与内源性抗原MHC的序列相同,那么可以引起有可能致关节炎的肽类不恰当的递呈,导致其他正常组织发生炎症反应。分子模拟在破坏自身免疫性疾病的B细胞耐受方面有一定作用。已有研究者在免疫球蛋白转基因小鼠模型中证实了模拟自身抗原的外源性抗原可以解除B细胞的外周耐受(peripheral tolerance),并有多个试验证实细菌dnaJ蛋白可能参与了RA的启动。
②抗软骨的自身抗体:已有很多证据支持软骨蛋白和蛋白多糖在RA发病中的作用。在BALB-c小鼠中,Ⅱ型胶原、聚合素、软骨连接蛋白和人软骨gp39都可诱导关节炎的发生。同时也有证据表明这些抗原在RA中可发生免疫反应。
A.Ⅱ型胶原:给大鼠、小鼠和灵长类动物免疫天然的Ⅱ型胶原可引发与RA相似的炎性关节炎。与其他类型的关节炎相比,在RA患者的滑膜中常可检测到抗Ⅱ型胶原抗体。如果在RA的早期发现该抗体,将预示有可能出现较为严重的症状。有实验显示,与对照组相比,口服Ⅱ型胶原的RA患者关节疼痛和肿胀的表现明显减轻。目前认为抗胶原抗体的致病机制可能是通过形成免疫复合物,激活补体从而引发炎症反应。因为在RA病人的血清及关节液中都可检出含有胶原的免疫复合物,而且这些免疫复合物均结合有C1q。不过,抗胶原抗体出现于RA发病之后,所以认为它是继发于关节组织的破坏,同时又参与关节组织的破坏,促进RA病程的发展。
B.人软骨糖蛋白39:在RA,人软骨糖蛋白39(HCgp39)是近来引起研究者关注的候选自身抗原。它是壳多糖酶家族的糖蛋白成员之一。它的功能目前尚未被清楚认识。HCgp39最初是从RA患者的滑液和血液中分离得到的,被认为是关节损伤的生化标志。它在关节的软骨细胞和滑膜细胞表达。用HCgp39免疫BALB-c小鼠可以诱发慢性可复发的关节炎,而对人RA来说,它可诱发血管翳的产生和软骨的降解。用HCgp39预处理的BALB-c小鼠表现出疾病发作的延迟和疾病活动度的减弱,这说明在动物模型中HCgp39可以诱导免疫耐受。而且用它可以成功地缓解处于活动期BALB-c小鼠的病情。这些资料显示了HCgp39作为维持滑膜B细胞反应的自身抗原在RA中的作用。
C.聚合素和软骨连接蛋白:聚合素(aggregation)是含有核心蛋白的软骨蛋白多糖(proteoglycan),它的糖胺聚糖侧链连有硫酸角质素和硫酸软骨素以及以N-连接和O-连接的寡糖。聚合素的结构包括三个球形区(G1、G2和G3)。软骨连接蛋白是一种小的糖蛋白,它起到稳定聚合素与透明质酸的作用。用非糖基化的核心蛋白或G1结构区免疫BALB-c小鼠可出现与RA相似的进行性多关节炎。在一部分RA患者的血清中可以检测到抗聚合素G1结构区的抗体。糖基化的蛋白多糖是诱导小鼠出现关节炎的重要组成成分。从软骨中释放出的蛋白多糖片段在维持RA滑膜异常免疫应答中起重要作用。
③应用于临床检测的自身抗体:
A.抗角蛋白抗体(antikeratin antibody,AKA):用间接免疫荧光法染色大鼠食道中段的角质层可以检测到AKA。AKA呈平滑的板层状。这种组织还可出现其他染色图形,但不仅仅局限于RA患者的血清中,因此必须加以排除。AKA-IgM对RA是非特异性的,而AKA-IgG对RA有高度的特异性。不过,纯化的角蛋白抗体对RA的特异性并不很高,这可能是由于RA特异性抗原是角质层中不同的成分。有50%左右的RA患者可出现AKA,而在正常人有0%~3%。尽管AKA检测的敏感度很低,但是它对RA的特异性达到95%~100%。更重要的是,约有34%的类风湿因子阴性的患者可出现AKA,在这类患者中,AKA具有一定的诊断意义。
B.抗核周因子(antiperinuclear factor,APF):上皮细胞颗粒层的透明角质颗粒中可以检测到核周因子抗原。这种颗粒呈卵圆形,直径0.2~0.3μm,每个细胞可有2~10个。只有合成软角蛋白的颊黏膜和食道黏膜等上皮细胞才表达这种抗原。目前已知这种抗原与profillagrin有关。APF的检测与常规的抗体实验室检测方法不同,因为产生这种抗原的细胞系很少,不太容易找到合适的供者(仅有10%的人其颊黏膜具有APF)。健康者的APF滴度为1∶5,而自身免疫病患者该抗体的滴度是1∶800。APF可以在RA、SLE、系统性硬化和传染性单核细胞增多症等患者的血清中出现。在RA,该抗体检测的敏感性高于AKA,但特异性低于后者。类风湿因子阴性的RA患者出现APF与疾病的严重程度、关节外表现,以及放射学的表现进展有关。
C.抗HnRNP蛋白抗体:约有47%的RA患者血清中存在IgG型抗异质性核RNP(Hn-RNP)核心蛋白A1的抗体。HnRNP复合物与前-mRNA有关,它与小nRNPs、Sm和nPNP不同,后者主要被SLE患者体内的抗体所识别。有趣的是,AKA的活性与抗A1抗体的出现相关,这表明AKA与HnRNP A1抗原有交叉反应。
1/3的RA患者可以检测出抗RA33kD抗体。该抗体在正常人血清中不存在,因此该抗体成为另一个血清学诊断有用的抗体。RA33kD也属于HnRNP核心蛋白,但它有别于A1。
D.抗聚角蛋白微丝蛋白抗体(anti-filaggrin antibody,A
FA):聚角蛋白微丝蛋白产生于哺乳动物上皮细胞分化的终末阶段。它是以原聚角蛋白微丝蛋白(profilaggrin)的前体形式在角质上皮组织中合成的。原聚角蛋白微丝蛋白沉积在上皮细胞的颗粒内,在细胞分化的过程中,经蛋白水解作用,释放出的聚角蛋白微丝蛋白。在这个阶段蛋白脱磷酸,约有20%的精氨酸残基经精氨酸脱亚氨基酶的作用转化为瓜氨酸。30%~40%的聚角蛋白微丝蛋白的氨基酸残基的重复单位变化多样,因此,聚角蛋白微丝蛋白的氨基酸序列存在很大的异质性。这也是A
FA在临床应用中最大的阻碍。
A
FA是与RA相关的IgG型自身抗体,其中包括AKA和APF。A
FA采用免疫印迹法或ELISA进行检测,有文献报道,该抗体的灵敏性和客观性较AKA和ARF的间接免疫荧光试验结果高。过去认为A
FA识别人类上皮组织的聚角蛋白微丝蛋白以及其他与原聚角蛋白微丝蛋白相关的蛋白。20世纪90年代末,在体外通过精氨酸脱亚氨基酶重组人聚角蛋白微丝蛋白得到A
FA蛋白的抗原决定簇,而且2/3来自聚角蛋白微丝蛋白合成多肽的中心部位是瓜氨酸。肽链分别与纯化的A
FA抗体、RA血清反应,只有含瓜氨酸的肽链才能被RA血清和A
FA抗体特异性识别。这些说明,瓜氨酸,是RA血清抗聚角蛋白.微丝蛋白相关抗体识别的主要组成性抗原决定簇成分。因此,人工合成的抗环瓜氨酸多肽抗体(anti-CCP antibody)。有文献报道,在敏感性方面,抗CCP抗体与RF相似,但特异性较后者有明显增高。Kroot等人临床观察认为,抗CCP抗体阳性的RA病人,骨质破坏的程度,较该抗体阴性者严重。由此可见抗CCP抗体对于RA的早期诊断和预后评估有一定的意义。
(8)固有免疫在类风湿关节炎中的作用:固有免疫(innate immunity)指的是对感染因素的非抗原特异性免疫应答,包括抗微生物肽、补体激活途径、甘露糖结合凝集素(mannose binding lectin,MBL)系统、自然杀伤细胞以及细胞因子的释放等在内的效应机制。与此相反,获得性免疫(adaptive immunity)是通过T细胞或B细胞产生抗原特异性的免疫应答,具有分辨自我和非我的功能。固有免疫应答不仅有促进炎症反应的作用,而且还可对获得性免疫有刺激或抑制作用。
研究固有免疫在RA中的作用,前提是某种感染因素直接刺激固有免疫系统,或机体释放可以启动滑膜炎症的非特异性细胞因子,尽管目前尚不知这种感染因素是什么。
有人提出,RA的发病似乎开始于滑膜衬里层细胞。这些细胞产生趋化因子,使得单核细胞和淋巴细胞进入关节内。如果单核细胞或淋巴细胞识别出关节内的某一种(或几种)抗原,那么淋巴细胞就会被保留下来,接着发生炎症反应。这个有“毒性”的环境可以改变T细胞表型。这个假设不需要某种特异性的致病因素,任何一种进入关节的病原体都可激发固有免疫应答。
根据对动物早期炎症性关节炎发病机制的研究,有人认为在RA也可出现类似的表现。固有免疫作为原始的推动力有可能在RA早期阶段吸引抗原特异性免疫应答,并有可能推动这一过程的进程。组织学的研究显示,固有免疫系统在启动RA滑膜炎症中的作用包括:滑膜中非特异性炎症可以刺激巨噬细胞释放细胞因子,导致树突状细胞分化并形成有效的抗原递呈细胞;滑膜中成熟的树突状细胞可以将抗原递呈给记忆性T细胞,诱导产生Th1或Th2反应;巨噬细胞可以吞噬细菌的片段,包括从机体黏膜表面进入关节的具有免疫刺激性的DNA;细菌产物刺激巨噬细胞分泌的局部细胞因子并再次激活树突状细胞、B细胞和自然杀伤细胞;关节内活化的补体系统增强局部的炎症反应和B细胞反应。
①树突状细胞(dendritic cell,DC)在RA固有免疫中的作用:研究发现,RA的滑膜组织以及滑液中含有丰富的树突状细胞,而这些树突状细胞具有潜在的抗原递呈细胞(APC)的功能。RA的树突状细胞具有以下一些特点:
A.大多数RA滑液中的DC表达某些分化标志分子,如高表达MHC-Ⅰ、HLA-DR和HLA-DQ分子。这点对于DC的抗原递呈功能很关键。
B.DC聚集在富含细胞因子的滑膜组织中,并在细胞因子的帮助下完成其表型和功能的分化。
C.在局部细胞因子的作用下,DC的分化也许导致Th1耐受,而诱导Th2应答,或诱导细胞发生抗凋亡小体内隐蔽抗原的应答。因此,研究认为DC可能参与了滑膜炎症的起始阶段,并且是促进RA滑膜炎症反应和T细胞免疫应答的重要因素。
②巨噬细胞在RA固有免疫中的作用:自人类认识RA以来,感染因素一直被认为是本病的驱动因素,但至今尚未找到感染的直接证据。巨噬细胞作为RA发病中重要的因素主要有以下一些依据:
A.巨噬细胞在某些微生物抗原的作用下,可以表达多种模件识别受体(PRR),如甘露糖受体、Toll受体、清道夫受体等,释放多种前炎症性细胞因子,如GM-CSF、IL-1、肿瘤坏死因子-α、IL-12、IL-15及IL-18等。
B.巨噬细胞可以作为抗原递呈细胞(APC),滑膜中的巨噬细胞大多数位于衬里层,这可能与滑膜中细胞因子的产生以及骨、软骨的破坏相关。不过与树突状细胞相比,巨噬细胞属于弱的APC。
C.巨噬细胞释放的局部细胞因子能再次激活树突状细胞、B细胞和自然杀伤细胞,并使树突状细胞进一步分化形成有效的APC。
③补体与MBL系统在RA固有免疫中的作用:补体蛋白既可以作为效应剂,也可有细胞因子样作用,例如,前者通过C5-9膜攻击复合体的作用直接破坏细胞膜。活化的补体蛋白可溶性肽片段具有细胞因子样作用,C5a是一种嗜中性粒细胞趋化因子,即可解释这一现象。RA关节腔内的免疫复合物为补体的活化提供了丰富的底物。肝脏是人类补体合成的主要来源,通过血清蛋白被动转运至关节液中。不过,关节液也能产生局部的补体蛋白。1970年,首次证实了滑膜组织可以合成补体蛋白。体外实验表明,在细胞因子存在的情况下,巨噬细胞和(或)成纤维细胞也可产生多种补体蛋白。例如,IFN-γ可诱导C2和C3的产生,IL-1和肿瘤坏死因子-α可诱导产生C3。
补体活化在RA炎症反应中起重要作用。主要有以下证据:
A.胶原诱导的关节炎(collagen-induced arthritis,CIA),病鼠的体内有补体活化产物。
B.在C5缺陷小鼠,CIA的发生和病情的发展受到抑制。
C.用抗C5单抗或补体活化抑制剂可溶性补体受体-1处理小鼠,可防止CIA的发生。
补体系统中蛋白活化的途径主要有3种,分别是补体经典途径、补体旁路途径和MBL途径。其中补体旁路途径是防止组织受伤的天然调节剂。在正常状态下补体旁路途径的激活是低度的,而在RA关节中,补体以旁路途径激活为主。此外,机体还存在天然的补体调节蛋白和人的膜结合补体调节因子。有证据提示,RA关节中补体调节蛋白表达降低,这些调节蛋白的缺陷使细胞更易出现不适当的裂解。
甘露糖结合凝集素(mannose-binding lectin,MBL)属于急性期蛋白,是由参与宿主固有免疫的肝细胞分泌的。MBL与甘露糖或N-乙酰氨基葡萄糖末端的配体结合,在不依赖抗体的情况下激活补体级联反应。MBL可以模拟免疫球蛋白和补体(C1q)的多种功能特性,因此,有人认为它不仅参与了防御细菌的第一道防线,而且还具备其他一系列活性,包括疾病的调节。MBL缺陷可导致反复感染,而且可加速RA病情的发展。研究显示,MBL缺陷者RA的发病年龄早,其关节病变也较重。通过对一组RA病人与健康人的对比研究发现,RA中MBL基因突变是造成MBL在血清中的含量很低,甚至无法检测到的原因。由此可看出,MBL的缺陷可以预测RA的发生以及疾病的严重程度。
④NK细胞在RA固有免疫中的作用:NK细胞可以在RA滑膜的衬里层和衬里下层检测到。RA早期可以发现大量颗粒酶B(granzyme B)染色阳性的NK细胞,但在RA晚期和骨关节炎中则很少见。这些NK细胞的水平与血清中急性期蛋白相关。而且,在RA患者的滑液和血清中可检测到高水平的可溶性颗粒酶A和B。这些说明NK细胞特别是在RA早期有一定作用,当它们被激活后可以释放细胞内颗粒的内容物。虽然NK细胞在对抗病毒感染的宿主防御中有重要作用,但是滑膜NK细胞并未与任何特异性的病毒感染相关连。
⑤热休克蛋白在RA固有免疫中的作用:热休克蛋白(heat-shock proteins,HSP)是一组具有多种功能的蛋白。HSP是对细菌、分枝杆菌和寄生虫等产生免疫应答过程中识别的主要抗原。例如,给予小鼠免疫结核分枝杆菌,可以产生抗HSPs70、60、18和12抗体。分枝杆菌的感染或免疫可诱导人类B细胞和T细胞对应激蛋白的免疫。人类的HSP60与分枝杆菌的HSP70具有相似的序列(约有60%具有同源性),这表明在细菌的感染过程中可能会诱导自身免疫反应的发生。在健康者可检测到针对自身HSP的T淋巴细胞,这可使我们得到这样的结论,即尽管存在产生自身免疫的危险性,但是对HSP的免疫识别在抗细菌免疫中有非常重要的作用。
在RA患者滑膜衬里层、软骨/血管翳交界处和皮下结节内细胞的细胞质中可检测到高水平的HSP60抗原决定簇,而在正常组织中则检测不到。RA患者的滑膜以及滑液细胞的细胞质中表达HSP60、HSP70和HSP90。其中HSP60表达于用IFN-γ处理过的巨噬细胞以及培养的Burkitt’s淋巴瘤细胞表面。因此,有人推测,滑膜细胞表面的HSP可以与滑液中的抗体形成免疫复合物。
⑥细胞因子在RA固有免疫中的作用:在固有免疫系统中存在两类细胞因子,分别是:
A.介导炎性反应的细胞因子,包括IL-1、肿瘤坏死因子-α、IL-6、IFN-α和IFN-β。
B.起调节作用的细胞因子,包括IFN-γ、TGF-β、IL-4、IL-5、IL-10、IL-12、IL-15和IL-18。其中有多种细胞因子参与了RA滑膜的炎症反应和组织损伤。机体中存在着多种固有免疫细胞因子的天然抑制物,提示这些细胞因子的前炎症性作用的内源性调节在防止疾病发生中起重要作用。
IL-1和肿瘤坏死因子-α由DC和巨噬细胞产生,在DC的早期分化中起重要作用。IL-1的天然抑制物IL-1Ra由巨噬细胞、嗜中性粒细胞和单核细胞产生,能与IL-1R结合,但不激活靶细胞。在许多RA患者滑膜液中IL-1Ra的表达水平较高。但是,高于细胞表面IL-1受体数量10~100倍的IL-1Ra仅能抑制IL-1活性的50%,因此,RA患者滑膜液中升高的IL-1Ra不足以抑制由IL-1引起的炎性作用。另外,IL-1和肿瘤坏死因子-α各自的可溶性受体也可阻止它们的活性。
树突状细胞和巨噬细胞是Th1细胞因子IL-12的重要来源,近来在RA滑膜的衬里层检测出IL-12的mRNA和蛋白质。实际上,RA患者血清中IL-12的水平与肿胀的关节数、疼痛的关节数和CRP水平相关,这说明IL-12在疾病过程中有一定的作用。IL-12是由p35和p40两条链组成的,单独的任何一条链,都没有生物活性。但是p40同型二聚体具有IL-12拮抗剂的功能。
还有一种重要的细胞因子IL-15,它是由树突状细胞、巨噬细胞、内皮细胞和成纤维样滑膜细胞分泌的。它可招引T细胞进入滑膜组织,随后使之发生活化。而且,它还可刺激滑膜T细胞产生肿瘤坏死因子-α。在体外,IL-15受体的可溶性α链可以作为IL-15的拮抗剂。
IL-18是由滑膜巨噬细胞产生的。它可与IL-12、IL-15共同诱导NK细胞和T细胞产生IFN-γ,还可刺激巨噬细胞分泌IL-1和肿瘤坏死因子-α。IL-18结合蛋白是IL-18内源性抑制剂。
综上所述,在RA滑膜中可以检测到固有免疫系统的主要细胞和分子,它们有可能通过非特异性抗原机制参与炎症的启动。但是,诸如补体抑制剂、MBL系统、成熟的树突状细胞、NK细胞的抑制性受体、抗炎性细胞因子以及细胞因子的拮抗剂等固有免疫系统的自然调节机制不足以阻止RA滑膜炎的发展。其中,固有免疫系统调节机制存在的缺陷有可能是遗传因素决定的,也可能受环境因素的影响。这些异常的调节机制在病人中表现为多种形式。不过,目前尚不清楚在RA中固有免疫是起非特异性的辅助作用,还是作为致病的主要形式存在。
4.骨与软骨的破坏 RA与其他炎症性关节病不同之处在于其滑膜有过度增生的倾向,并可对与滑膜接触的局部软骨与骨,产生侵蚀作用。多种机制参与了这一过程(表10)。软骨与骨并不是组织遭到破坏的惟一目标,软骨细胞和破骨细胞也参与了组织细胞外间质的丢失过程,而且RA关节破坏的目标还包括韧带和肌腱。
在生理条件下,人体的软骨与骨的合成和降解处在一种动态的平衡中,而这种平衡在RA被多种因素破坏,造成结缔组织的持续降解,以致出现软骨与骨的进行性和不可逆性破坏。其中参与的因素包括:①诸如IL-1等细胞因子对关节完整性的破坏有重要作用;②血管生成素以及能够促进血管生成的其他因子,它们不但能增强炎性细胞侵蚀关节组织的能力,还可向炎症性细胞和增生细胞提供充足的养料;③趋化因子可将嗜中性粒细胞带入关节腔内,这些趋化因子包括C5a、白三烯B4和血小板活化因子,在关节腔内嗜中性粒细胞释放蛋白酶和趋化分子;④纤溶酶,是由纤溶酶原激活物作用于纤溶酶而形成的,可以使蛋白酶的释放起到放大的作用;⑤滑膜组织产生的中性蛋白酶包括胶原酶和间质溶素,主要参与对软骨与骨的侵蚀;⑥纤维蛋白覆于滑膜和软骨上,凝血的级联反应可进一步促进组织的损伤。尽管许多介质存在天然的抑制剂,但它们都不足以减弱RA的炎症反应。
(1)软骨破坏的机制:关节软骨是由大量的间质和少量的软骨细胞组成的。其中,胶原纤维、蛋白多糖、水等组成软骨间质。软骨细胞可合成并分泌胶原蛋白、蛋白多糖以及其他作用于间质的蛋白。RA软骨的破坏主要是指细胞间质的降解,这一过程实际上是间质被水解蛋白酶消化的过程。
RA软骨的破坏是酶和力学作用的过程。在IL-1、肿瘤坏死因子-α等细胞因子的刺激下,滑膜内细胞释放各种降解软骨间质的酶,它们或以游离的形式,或以与离子结合的形式造成关节的破坏。在滑膜炎早期,在IL-l等作用下,多种蛋白酶使软骨细胞的蛋白多糖逐步被消化,导致软骨的力学作用减弱。当蛋白多糖完全从软骨中消失,软骨即失去对外界负重造成变形的恢复能力。随着胶原酶和间质溶素对软骨的作用,最终使其失去了功能的完整性。另外,有证据表明,软骨细胞也可产生金属蛋白酶。研究显示,RA软骨间质溶素和胶原酶mRNA水平明显增加。因此,软骨的破坏是在多方面机制的作用下完成的,不仅有富含蛋白酶的滑液的作用,侵蚀性血管翳的作用,而且还有软骨细胞自身的破坏作用。
①间质金属蛋白酶(MMPs):间质金属蛋白酶(matrix metalloproteinases,MMPs)是一大组酶,在胞外间质的降解和重塑中有重要的作用。因为间质(包括胶原和蛋白多糖等)的降解在RA关节的发病中占据着重要的位置,所以了解调控MMPs的机制十分重要。尽管这一家族中每个酶的特点不尽相同,但是它们在结构上具有许多相似之处,这点说明它们有来自共同的基因。一般MMPs是以无活性的酶原形式分泌,只有经蛋白分解后才具活性。而这种蛋白分解作用需要有锌离子的存在。锌离子与MMPs上的半胱氨酸螯合形成无活性的酶,当失去这种结合时,MMPs才具有蛋白水解的活性。一般情况下,切断螯合的半胱氨酸释放出具有活性的片段,同时,锌离子也参与了酶的反应。在某些条件下,如纤溶酶,经活化后半胱氨酸仍保留在酶的结构中,但是当有足够的肽,被剪切后,残基就不再与金属阳离子形成对合。另外,MMPs在结构上的共同之处还包括具有相似的催化结构域。MMPs配体的特异性是独特的。例如,具有三螺旋结构的胶原酶可以降解I、Ⅱ、Ⅲ、Ⅶ和X型胶原,而白明胶酶则可降解变性的胶原。间质溶素(stromelysin)的特异性更广泛,它不但可剪切和活化胶原酶,还可降解蛋白多糖。
细胞因子不但可以诱导滑膜细胞合成金属蛋白酶,而且可改变胞外间质的产生和降解之间的平衡状态。PDGF可以直接诱导间质细胞产生蛋白酶,同样,趋化因子也可有类似的作用。在出现血管形成(angiopoiesis)和凝块时,PDGF作为血小板激活物被大量释放入RA的组织中。IL-1和肿瘤坏死因子α也可直接诱导多种细胞表达金属蛋白酶基因,包括成纤维样滑膜细胞。当这两种细胞因子联合出现时,它们的作用有叠加效应或协同效应。在体外的动物实验表明,虽然RA滑膜的培养基可以刺激软骨的降解,但它可被IL-1的抗体所抑制。这些研究意味着RA滑膜作为激活软骨细胞产生蛋白酶的IL-1的主要来源。另外,IL-6并不诱导滑膜细胞产生金属蛋白酶,但可增加TIMP-1的产生。
MMPs的作用,不仅依赖酶的产生速度,还与酶特异性抑制剂相关。现已克隆并分析得到两种MMPs的抑制剂,被称为金属蛋白酶的组织抑制剂-1(tissue inhibitor of metalloproteinase,TIMP-1)和TIMP-2。这两种抑制剂的序列约有38%具有同源性,它们通过化学计量的方式(1∶1)与金属蛋白酶结合,从而阻断蛋白酶的作用。该抑制剂与金属蛋白酶的结合是可逆的,并有很高的亲和力。
在MMPs,特别是间质溶素和胶原酶,它们是主要降解结缔组织间质的酶,被认为是RA关节损伤的主要介质。下面分别介绍这两种MMP以及TIMF。
A.间质溶素(stromelysin):间质溶素又称MMP-3,只有当pH在7~8它才具有最大的生物活性。间质溶素对间质胶原的降解作用很小,而它可降解Ⅳ型胶原、纤维连接蛋白(fibronectin)、层粘连蛋白(laminin)、蛋白多糖核心蛋白和Ⅸ型胶原。另外,间质溶素还参与原胶原酶的激活。
B.间质溶素基因最早是从大鼠转化的成纤维细胞中发现并克隆得到的。早期对该蛋白酶的研究发现,它可以降解软骨间质。从RA动物模型的滑膜组织中可分离得到间质溶素mR-NA,经免疫组化染色发现在滑膜衬里层细胞、软骨细胞和破骨细胞内有间质溶素蛋白。随后在RA患者滑膜的衬里层和衬里层下检测到间质溶素蛋白。与骨关节炎的滑膜组织相比,前者含有的间质溶素蛋白相对较多。令人感兴趣的是,用间质溶素作探针对滑膜组织行原位杂交,发现间质溶素在滑膜组织中的分布不同,绝大多数mRNA出现于滑膜衬里层,而不是衬里下层。看来,间质溶素蛋白是由衬里层细胞产生的,并渗入衬里下层被其他细胞所吸收。除了间质溶素,已从RA滑膜细胞的cDNA文库中克隆得到与金属蛋白酶具有高度同源性的被称为间质溶素-2的蛋白酶。
②胶原酶:胶原酶又被称为MMP-1。像间质溶素一样,RA滑膜细胞也可以分泌大量的胶原酶。1967年,首次在RA滑膜体外培养基中发现胶原酶-1。RA滑膜组织中的胶原酶在pH 7~8的环境下可以发挥最大的生物活性。胶原酶主要对I、Ⅱ、Ⅲ、Ⅶ和X型胶原等间质胶原产生降解作用,而对Ⅳ、Ⅴ、Ⅸ型胶原以及其他非螺旋结构的胶原则不产生类似的效应。研究表明,在RA胶原酶基因的表达范围很广。虽然间质溶素和胶原酶都是由慢性RA患者的滑膜衬里层细胞产生,但是对它们在疾病早期的定位尚不清楚。研究发病数天内的胶原性关节炎动物模型,发现滑膜和软骨细胞中都含有免疫反应性的间质溶素。与之相反,在滑膜中可检测到胶原酶,而软骨中则检测不到。而且发现这两种酶在血管翳-软骨交界处的染色明显加重。上述这些研究表明,在炎性关节炎的早期即可产生金属蛋白酶,而且软骨细胞也参与这一过程。另外,间质溶素与胶原酶,并不总是同时表达,因为在培养的RA滑膜细胞中间质溶素与胶原酶转录的机制不同。
与其他效应分子一样,胶原酶分泌的调控也是由细胞因子介导的。其中IL-1和肿瘤坏死因子-α是最有效的诱导剂。在受到细胞因子刺激的数小时内,胶原酶mRNA即可出现聚集,并逐渐增加。而对于受IL-1和肿瘤坏死因子-α刺激的滑膜细胞,IFN-γ可减弱其胶原酶的活性。令人感兴趣的是,IL-1和肿瘤坏死因子-α之间的相互作用并不会使胶原酶基因的表达下降,或是增加TIMP的产生。研究表明,IFN-γ可以特异性抑制IL-1介导的间质溶素的产生,由于间质溶素是胶原酶有效的激动剂,上清液中间质溶素数量的减少可能会影响胶原酶的活性。同样,IFN-γ也可抑制肿瘤坏死因子-α介导的胶原酶的产生,不过其中的作用机制尚不清楚。
③金属蛋白酶组织抑制剂(TIMP):目前对TIMP在RA中的调节作用机制知之甚少。对一些冷冻的滑膜组织行原位杂交研究显示,RA患者滑膜衬里层含有大量的TIMP-1 mRNA。与胶原酶相反,有关TIMP基因的表达在RA和OA十分相似。也就是说,TIMP与胶原酶的比例在非炎性关节炎比RA更高。这里也解释了RA软骨破坏和受到侵蚀的一种机制,即RA中产生过量的金属蛋白酶掩盖了TIMP对软骨的作用。
用胶原酶或TIMP特异性抗体对滑膜组织行免疫荧光染色,结果显示滑膜衬里层可以合成这两种蛋白。另外,IL-1和肿瘤坏死因子-α虽然可以显著增加间质溶素的产生,但是对TIMP-1基因表达的影响微乎其微。
④半胱氨酸蛋白酶——组织蛋白酶:组织蛋白酶是一组具有广泛水解活性的半胱氨酸蛋白酶,可以作用于Ⅱ、Ⅸ和Ⅺ型胶原以及蛋白多糖。与MMPs一样,组织蛋白酶也受到细胞因子和原癌基因(ras)的调控。IL-1和肿瘤坏死因子-α可以诱导成纤维样滑膜细胞培养基表达组织蛋白酶L。原位杂交的研究显示,RA滑膜有组织蛋白酶B和L的表达,特别是在受侵蚀的部位。组织蛋白酶K,是近年新发现的一种半胱氨酸蛋白酶,在所有的组织蛋白酶中它具有独特的作用,即可降解Ⅰ型胶原。RA滑膜组织的巨噬细胞和成纤维细胞都可表达组织蛋白酶K。已证实组织蛋白酶作为骨破坏的介质,因为在佐剂性关节炎的动物模型中发现半胱氨酸抑制剂明显减少。
(2)局部骨侵蚀的机制:RA的放射学的改变包括近关节处出现骨质减少、软骨下骨的局灶性骨侵蚀和血管翳侵袭关节边缘。已有多项研究表明,有关局部的骨侵蚀随着疾病的进展而加重,一般来说与疾病的严重程度相关。
①RA局部骨侵蚀的细胞机制:许多证据显示,在正常生理状态下破骨细胞主要起骨吸收作用。它来自于单核细胞/巨噬细胞的前体,通过表达独特的整合素、基质金属蛋白酶和组织蛋白酶K和抗酒石酸磷酸酶完成骨吸收的作用。在RA,抗酒石酸磷酸酶(TRAP)是一种破骨细胞的标记物,表达于破骨细胞表面。这说明破骨细胞可能在RA骨侵蚀方面有一定作用。另外,破骨细胞与其前体的最大不同是前者表达降钙素受体,该受体可与多肽激素降钙素结合,使得破骨细胞骨吸收的作用受到抑制。
矿化的骨细胞外间质对蛋白酶的攻击有保护作用。局部骨侵蚀的第一步是招募并分化表达破骨细胞表型的细胞。在骨骼受侵蚀的部位具有典型的多核巨细胞,它可表达所有成熟的破骨细胞基因,这些基因包括酸性磷酸酶、组织蛋白酶K和降钙素受体。邻近血管翳含有大量的巨噬细胞,它们产生IL-1、肿瘤坏死因子-α,并与来源于T细胞的细胞因子IL-17等的炎性介质,将多核巨细胞分化成破骨细胞。根据对动物模型的研究发现,可溶性破骨细胞分化因子的受体和osteoprotegerin有阻止骨受到侵蚀的作用。
生理性的骨重塑主要是重吸收的骨与新形成的骨两者之间的数量保持一种动态平衡,而RA患者这种平衡被破坏。确定是否由破骨细胞或其他类型的细胞造成局部骨吸收导致出现骨侵蚀,对于理解RA局部骨丢失的作用机制是一个关键。
②调节破骨细胞分化和活化的因子:近来,越来越多的证据表明,细胞因子参与调控破骨细胞的分化和活化。包括可以直接作用于破骨细胞前体诱导其增生和分化的因子,诸如M-CSF、IL-6、IL-11、IL-1α或IL-1β和肿瘤坏死因子-α等。还有许多因子间接地参与了破骨细胞这一过程,包括甲状旁腺激素、与甲状旁腺激素相关的多肽、1,25(OH)2维生素D3、前列腺素E2、IL-11、雌激素和糖皮质激素等。令人感兴趣的是,IL-1α或IL-1β可以直接作用于破骨细胞,而肿瘤坏死因子 α通过作用于破骨细胞的前体间接地起到增强破骨细胞活性的作用。
最近发现一种被命名为破骨细胞分化因子(osteoclast differentiation factor,ODF)也有称之为osteoprotegerin配体(OPGL)或与肿瘤坏死因子相关的诱导激活细胞因子,它是分化破骨细胞有效的调节剂,是由滑膜中成纤维样细胞分泌的。该因子是肿瘤坏死因子配体家族的膜结合成员。ODF主要对破骨细胞的成熟过程起调控作用。成骨细胞和活化的T细胞也可以产生ODF,其中T细胞可能对RA中破骨细胞和成骨细胞功能的平衡起到一定作用。研究显示,许多增强破骨细胞形成或其活性的因子都需要通过下调ODF(或OPGL)的表达才能产生介导对破骨细胞或衬里层细胞的作用。
还有一组因子将ODF作为NF-κB配体的受体激动剂(RANKL),成为促进T细胞的生长和树突状细胞功能的因子。该因子又被称作RANKL/ODF。研究发现,ODF的信号受体就是NF-κB的受体激动剂(RA2NK),它在多种细胞表面表达,包括破骨细胞和破骨前体细胞、某些B细胞和T细胞以及树突状细胞。ODF与RANK的相互作用可使前体细胞分化为破骨细胞,这些因子的过度表达可造成骨的再吸收。
此外,还检测到RANKL/ODF的可溶性“decoy”受体,被称为osteoprotegerin(OPG)。OPG相当于破骨细胞形成抑制因子。在结构上它与RANK不同,但是它可结合破骨细胞分化因子,阻止后者对破骨细胞的分化或活化。
③参与RA局部骨侵蚀的因子:RA滑膜组织产生大量与调节生理骨重塑相关的因子,其中包括IL-1a或IL-1β、IL-6、IL-11、M-CSF和肿瘤坏死因子-α。对RA动物模型的研究显示,IL-1和肿瘤坏死因子-α在炎性关节炎局部骨侵蚀的发病中有非常重要的作用。例如,在胶原性关节炎的动物模型中,给予能够中和IL-1的抗体即可阻止骨和软骨的破坏。此外,有人发现虽然阻断肿瘤坏死因子-α可以减轻RA的炎症,但是只有阻断IL-1才能防止骨与软骨的丢失。不过,对于RA患者在临床上应用IL-1和肿瘤坏死因子-α抑制剂可减轻关节的炎症表现,并可推迟骨侵蚀的进展。
最近,一研究小组对RANKL/ODF在RA骨重吸收机制中的作用进行了描述。应用原位杂交和RT-PCR技术,他们发现取自RA滑膜组织培养的成纤维细胞和活化的CD4 淋巴细胞可以表达ODF mRNA;同样,取刚分离的,RA滑膜组织的CD4 和CD8 淋巴细胞也表达ODF mRNA。应用免疫荧光可直接证明RA滑膜中有RANKL/ODF蛋白的存在。Kong等人用佐剂性关节炎的动物模型研究表明,ODF、在破骨细胞介导的骨重吸收中有一定作用,例如,给予刚发病的动物一定的OPG,可以看到骨皮质和骨小梁的骨丢失被完全抑制。
(3)各种类型的细胞在RA关节破坏中的作用:在RA早期,由于滑膜衬里层细胞数量的增多和细胞形态的肥大造成滑膜增厚。促炎症性细胞因子IL-1和肿瘤坏死因子-α刺激黏附分子在内皮细胞的表达,并增加招募嗜中性粒细胞进入关节腔。嗜中性粒细胞可释放蛋白酶,主要降解软骨表层的蛋白多糖。当蛋白多糖全部消化后,免疫复合物便进入胶原的表层,并暴露出软骨细胞。在IL-1和肿瘤坏死因子-α的刺激下,或在存在活化的CD4 T细胞情况下,软骨细胞和滑膜成纤维细胞可释放MMPs。随着病情的进展,滑膜组织逐渐转变为炎性组织,其中一部分有新的血管生成,即形成血管翳。这种组织具有侵蚀和破坏邻近的软骨和骨的功能。
①血管翳:关节软骨除了具有弹性和伸展性,而且对软骨下骨是一种保护屏障,避免滑膜组织和滑液中的炎性物质对骨的侵蚀。不过,位于软骨边缘的骨,没有软骨的保护成为“裸区”。在该处,滑膜可以直接与骨接触。衬里层细胞常覆于软骨表面。与软骨下骨不同,“裸区”既没有任何保护可以避免酶对骨的降解,也无法阻止局部细胞的侵蚀。
RA与其他的炎性关节炎不同之处在于滑膜组织明显增厚,并对与之接触的软骨和骨有局部侵蚀性。这种具有破坏性的组织被称为“血管翳”。在RA病变关节的放射学检查中可以观察到血管翳边缘侵蚀的特性。
血管翳的组织学特点与其他部位的滑膜不同。特别是它的主要组成细胞以衬里层细胞为主,衬里下层细胞很少。这种衬里层细胞具有以下特点:A.具有增殖性间质细胞的外形;B.细胞核呈多形性;C.高表达原癌基因;D.含有大量编码金属蛋白酶的mRNA。在缺少T淋巴细胞的情况下,血管翳仍具有侵蚀的特点,这意味着RA滑膜细胞能够表达某些转化细胞的特征。在关节软骨与骨,受侵蚀的过程中,由滑膜和血管翳产生的生长因子和细胞因子起着调控作用。对血管翳而言,组织破坏的特性与间质金属蛋白酶以及其他能够降解胶原和蛋白多糖的蛋白酶密切相关。
根据血管翳所含细胞形态的不同,可将其分为两种类型:一种位于侵蚀性血管翳/软骨结合处(或血管翳/骨结合处),可见大量的巨噬细胞和成纤维细胞及新生血管,侵及软骨细胞及间质,造成软骨的破坏;另一种血管翳常见于负重的关节软骨的边缘。其形态学特点在炎性的血管翳与软骨之间,可见由成纤维细胞和纤维组织构成的移行区,软骨的破坏不明显,代表纤维组织修复的过程。
血管翳的原始细胞能够表达滑膜细胞和软骨细胞的表型和功能特点,根据这些细胞的起源称之为血管翳细胞。它们的外形呈菱形,在培养基中可持续生长。此外,与滑膜细胞和软骨细胞相比,该细胞的表面高表达VCAM-1,有助于T细胞的黏附。研究发现,血管翳细胞具有某些软骨细胞的特点,因为它可表达诱导性淋巴细胞抗原和诱生型一氧化氮合成酶,其中前者属于肿瘤坏死因子-神经生长因子家族。而成纤维样滑膜细胞并不表达上述基因。令人感兴趣的是,血管翳细胞与滑膜细胞相似,不产生NO合酶,尽管它们含有NO合酶mRNA。不过,血管翳细胞具有更多成纤维样滑膜细胞的特点,因为它们可产生I型胶原,而不是Ⅱ型胶原,而且,像滑膜细胞一样,它们细胞内含有波形蛋白。但是,也有研究表明,血管翳来源的细胞可表达Ⅱ型胶原基因或产生蛋白多糖。总的来说,目前的资料尚不能说明血管翳细胞是来源于软骨细胞分化的细胞,还是成纤维样滑膜细胞,或者它们代表着一独立的细胞系。但是,它们可分泌胶原酶,并能直接侵蚀软骨。
②成纤维样滑膜细胞:成纤维样滑膜细胞是从RA滑膜中分离得到的外观类似成纤维细胞的一类在RA滑膜中占主要位置的滑膜细胞。近年来,随着对成纤维样滑膜细胞研究的深入,发现它具有一个重要的特性,即转化特性。因为从很多方面看这种细胞的行为和形态特点更像是关节内具有局部侵蚀性的肿瘤。实际上,不论在体内还是体外,RA滑膜细胞都表现出细胞转化的很多特性,包括:A.从形态上看,细胞核大而苍白且呈纺锤形;B.呈非依赖性贴壁生长;C.非接触性抑制,在体外的培养中可以看到,特别是在PDGF这种重要的成纤维样滑膜细胞生长因子存在的情况下;D.与肿瘤基因的活化相关,如egr-1、c-fos、c-iun、c-myc、c-sis、c-H-ras等;E.以单克隆或寡克隆形式增殖;F.端粒末端转移酶(transferase)活性增强;G.体细胞突变,如p53、H-ras、hprt。
在RA的发病中,具有转化特性的成纤维样滑膜细胞存在原癌基因的过度表达、能够产生生长因子并可生成过多的间质降解酶,因此在关节破坏过程中发挥着重要作用。它主要从两个方面对RA关节产生破坏作用:A.自主增殖;B.产生多种对软骨或骨有侵蚀作用的酶,如MMPs、聚合素酶(aggrecanase)和组织蛋白酶。
③软骨细胞:软骨细胞可以合成并分泌胶原蛋白与蛋白多糖以及其他胞外间质。同时,它还可分泌多种细胞因子,如IL-1、肿瘤坏死因子-α、IL-6、IL-8等,亦可产生MMPs和TIMP。在正常生理状态下,这些细胞因子、酶及抑制剂之间保持平衡,调节软骨间质的产生和破坏,以维持正常的代谢和功能。而在RA,由于MMP和促炎性细胞因子产生的增加,造成软骨间质的破坏。
在RA,IL-1、肿瘤坏死因子-α和TGF-β等多种细胞因子对蛋白酶的产生起着调控的作用。这些细胞因子大多数是由位于滑膜的巨噬细胞分泌的。软骨细胞对这些细胞因子的应答一方面表现为胶原和蛋白多糖合成的减少,另一方面表现为刺激胶原酶和间质溶素合成的增加,而后两者可降解软骨中的Ⅱ型胶原和蛋白多糖。
现已知RA滑膜组织中的细胞凋亡现象明显增加。其中,RA组织破坏的机制之一即是细胞凋亡导致软骨细胞受损。
④T细胞和巨噬细胞:在RA中,有多种类型的细胞参与了导致组织破坏的发病机制(即软骨的消化和骨的侵蚀)。其中,RA患者滑膜中的T细胞和巨噬细胞,可直接或借诱导酶合成的“downstream”效应产生破坏组织的各种细胞因子。
虽然T淋巴细胞已被证明参与了RA的发病,但是它们在发病机制中的作用尚不十分明确。巨噬细胞是血管翳中另一类主要的细胞,因为它们可释放多种,促炎症性细胞因子,如肿瘤坏死因子-α、IL-1β和IL-17,这些细胞因子参与诱导成纤维样滑膜细胞分泌MMP和破骨细胞OPGL的表达。MMPs参与对软骨的降解,而OPGL诱导破骨细胞的成熟,参与骨的再吸收。
在RA患者滑膜和血液中的巨噬细胞可检测到一氧化氮(NO)的水平增高。另外,巨噬细胞、多形核细胞、淋巴细胞、NK细胞和内皮细胞都可出现诱生型NO合酶。经诱生型NO合酶的作用,NO可介导消灭细胞内的一些病原体和肿瘤细胞,而且,NO不但可引起软骨细胞的凋亡,还会影响Th1与Th2细胞的比例,在关节组织的破坏过程中有一定作用。
研究发现,RA滑膜中的T细胞能产生ODF,而后者可间接作用于那些在RA局部骨侵蚀的发病中起作用的细胞。而且,来自T细胞的细胞因子也有调控破骨细胞分化的作用。例如,IL-17是由RA滑膜组织的Th1和Th0细胞产生的,出现于RA滑液中。在动物模型中,IL-17表现出能刺激破骨细胞的分化。IL-15是另一种RA滑膜T细胞产生的细胞因子,近来发现它可诱导破骨细胞的活化。与此相反,IL-18是由破骨细胞样细胞和活化的巨噬细胞产生的,可通过诱导T细胞产生GM-CSF因子来抑制破骨细胞的分化。
⑤嗜中性粒细胞:嗜中性粒细胞在RA中表现出明显的区室化(compartmentalization)。在增殖的滑膜组织中只有极少量的嗜中性粒细胞,而在滑液中它则是主要的组成成分。至于出现这种区室化的原因尚不清楚。虽然嗜中性粒细胞在滑膜中并不起重要的作用,但是它们对软骨的破坏方面占有突出的位置。嗜中性粒细胞通过氧自由基作用于病原体。嗜中性粒细胞内的酶,允许氧增加一个电子,导致产生过氧化物基团;同时,过氧化物歧化酶形成的过氧化氢和氢氧根基团可以转移电子。所有这些氧代谢产物具有高毒性。在RA滑液中发现活性氧水平增高,但是它们对关节组织的破坏机制尚不清楚。
目前已知嗜中性粒细胞可被滑液中诸如IL-8、GS-CSF和免疫复合物等一些因子激活,当它吞噬并消化免疫复合物后,可以释放细胞内含有的各类溶菌酶类(如髓过氧化物酶、溶菌酶、弹性蛋白酶、胶原酶和白明胶酶),并产生可以损伤软骨和对骨具有破坏性的氧自由基。其中,免疫复合物沉积于软骨最上层,有利于嗜中性粒细胞直接作用于软骨,而且便于聚集有活性的蛋白酶和氧代谢产物,对软骨产生侵蚀作用。
5.类风湿关节炎发病机制的模式 随着越来越多的细胞因子被发现,以及对TCR和巨噬细胞/成纤维细胞功能研究的深入,使得研究者重新修订传统的RA发病机制的模式。近来提出一范例试图解释在巨噬细胞/成纤维细胞高度活化的情况下,RA滑膜组织出现的T细胞应答反应。目前一致认为,RA的起始阶段有可能是由T细胞介导的一抗原特异性的过程。致关节炎抗原尚未发现,有可能是反转录病毒、某种细菌的产物或其他生物体,如衣原体、分枝杆菌、螺旋体等。对于RA易感者而言,出现早期T细胞的应答,导致细胞因子的分泌,随后招募包括嗜中性粒细胞、巨噬细胞、B细胞和记忆性T细胞在内的多种炎性细胞,它们具有广泛的抗原特异性。当疾病确立后,逐渐分化为3种RA基本模式。不过,重要的是,必须清楚地认识到这3种模式只是用来解释慢性滑膜炎发展的持续阶段,而非疾病的起始阶段。同时,还应该了解这3种模式并不是各自孤立的,而是可以相互作用的(图4)。
(1)T细胞介导的免疫应答:如果滑膜组织中持续存在某种致关节炎抗的免疫应答。已有许多实验结果支持这一论点。例如,莱姆病的关节损害与RA十分相似,而莱姆病的致病抗原就是螺旋体抗原。HLA-DR的表面密度在滑膜衬里层细胞和巨噬细胞很高,这说明存在活跃的抗原递呈活动。此外,来自滑液和衬里层下组织的T细胞常表达细胞表面活化的标记物,如MHCⅡ抗原和转铁蛋白受体。位于“过渡区(transitional areas)”的淋巴细胞与富含HLA-DR的辅助细胞密切相关。这些活化细胞的产物有可能诱导MHCⅡ抗原的表达,促使滑膜衬里层细胞的增生,并支持B细胞的生长与分化。诸如胸导管引流、全身淋巴放疗和环孢素A等针对T细胞的特异性治疗对RA病情的改善有一定作用,这一事实也支持T细胞介导的免疫应答在RA中有重要作用。
T细胞介导的免疫应答产生RA滑膜炎这一观点从理论上可以解释RA的许多特征,包括:①T淋巴细胞的聚集;②滑膜衬里层细胞过度增生;③B细胞过度活跃,局部产生自身抗体。
不过,目前有一些现象尚不能用这一模式解释:①关节内产生的可溶性介质来源于非T细胞;②现有手段检测到T淋巴细胞产生的细胞因子的数量非常少;③来自T细胞介导的因子在人类其他T细胞介导的疾病中也可检测出,如胸膜结核、皮肤的迟发型超敏反应或过敏原诱发的哮喘等。这些问题的出现使得研究者提出了RA发病的其他假设模式。
(2)自身反应性T细胞:RA的慢性关节损伤可能是对抗原应答的结果,这与疾病的起始阶段不同。在其他自身免疫性疾病中也曾提出过相似的发病机制,例如,
自身免疫性甲状腺炎即是对某种推测病毒的侵袭产生适当的免疫应答,导致局部分泌IFN-γ,后者诱导甲状腺细胞表达HLA-DR,使之成为免疫攻击的对象或作为抗原递呈细胞。携有HLA-DR的刺激细胞与自身T淋巴细胞之间的反应被称作自身混合性淋巴细胞反应(autologous mixed leukocyte reaction,AMLR)。RA患者的滑膜可出现局部的AMLR,主要有以下依据:①富含细胞因子的RA滑膜与AMLR中的情况非常相似,即诸如IL-2和IFN-γ等来自T细胞的细胞因子数量非常少;②RA关节液中检测到的细胞毒性T淋巴细胞与AMLR产生的NK样细胞具有相似性;③关节腔和关节滑膜中含有多种潜在的刺激细胞,它们与应答细胞的位置非常接近。其中应答细胞包括A型滑膜细胞和树突状细胞,后者是AMLR最有效的刺激物。
除了MHCⅡ抗原外,慢性滑膜炎中的滑膜T细胞可以直接针对其他自身抗原产生应答,并被释放至富含T细胞的环境中。针对Ⅱ型胶原的免疫应答就是其中的一个例子。此外,也可通过分子模拟的方式使自身反应性T细胞受到刺激,例如,热休克蛋白、蛋白多糖和EB病毒就是通过这种方式产生免疫应答的。
(3)旁分泌/自分泌模式:前面提及的RA持续阶段的两种发病机制的模式主要围绕着T淋巴细胞。在这些模式中,T细胞的产物分布于整个组织中,直接刺激滑膜衬里层下的巨噬细胞和滑膜细胞,诱导黏附因子表达于后毛细血管高内皮细胞静脉,并通过B细胞的增生与分化刺激局部免疫球蛋白的产生。不过,正如前所述,研究发现关节腔内活化的T细胞的产物不仅数量少,而且所起的作用也不大(表11)。
与之相反,滑膜内巨噬样细胞和成纤维样细胞分泌的细胞因子,如IL-1、肿瘤坏死因子-α、IL-6、GM-CSF、M-CSF、TGFβ、前列腺素、补体蛋白、TIMP、胶原酶等,在滑膜组织和滑液中的含量十分丰富。根据超微结构分析和细胞表面HLA-DR的表达,显示这些细胞具有活化的表型。这些表明,RA的慢性滑膜炎是在T细胞作用下产生的这一传统观点应该有所改变。也就是说,关节衬里层邻近的巨噬细胞和滑膜成纤维样细胞以旁分泌或自分泌的形式产生大量的细胞因子,维持并促进滑膜炎症的发生与发展。在关节腔内已识别出多种参与这一过程的细胞因子,并能解释滑膜衬里层细胞的增生、HLA-DR的诱导和滑膜新生血管的形成。
图5是存在于滑膜细胞间复杂的细胞因子网络示意图,涉及巨噬细胞和成纤维细胞,由于T细胞分泌的细胞因子难以检测,故其细胞因子是否参与疾病的过程尚不清楚。
IL-1和肿瘤坏死因子-α都是由滑膜巨噬样细胞分泌,它们可以刺激成纤维样细胞的增生,增加IL-6、GM-CSF和诸如间质溶素和胶原酶等效应分子的分泌。GM-CSF是由滑膜巨噬样细胞以及在IL-1β或肿瘤坏死因子-α刺激下的成纤维样滑膜细胞产生的,它是IL-1、肿瘤坏死因子-α和IL-8产生的诱导剂。特别是在肿瘤坏死因子-α的协同下,GM-CSF还可以增加巨噬细胞和单核细胞表面HLA-DR的表达。成纤维样滑膜细胞具有自分泌反馈环,可以通过分泌成纤维细胞生长因子(FGF)作用于自身的调节。巨噬细胞和成纤维细胞产生的局部细胞因子还可作用于T细胞,并能适度调节T细胞的活性。B细胞的活化以及RF的产生有可能是非T细胞作用机制的结果。因为转化表型依赖于FGF和PDGF等细胞因子以自分泌形式的刺激,所以说具有转化特性的滑膜细胞也符合旁分泌/自分泌的特点。据推测,这一模式还有一个特点,即细胞因子以非抗原特异的方式吸引T细胞进入关节滑膜。
细胞因子的抑制剂在自分泌/旁分泌模式中也发挥着一定作用,因为负反馈环可能是一种重要的调控滑膜炎症反应的正常内环境稳态机制。不过,这些抑制剂并不能有效地阻止,促炎症性细胞因子的作用。例如,从理论上讲,IL-1Ra能够对RA的发展有一定的阻碍作用,但事实上,尽管关节内有大量的IL-1Ra,滑膜炎症仍持续进展。
(4)T细胞-巨噬细胞-成纤维细胞轴:上述3种有关RA的发病机制模式实际上包括一系列的基本原理与理论。目前认为,RA滑膜炎症的持续阶段是上述三种模式共同完成的,即是T细胞、巨噬细胞和成纤维细胞相互作用的结果。
我们研究疾病发病机制的目的是为了能够采取更积极主动、更全面的治疗措施。因为RA涉及的这些细胞相互之间的关系错综复杂,所以针对其中任何一种模式的治疗都不可能取得十分满意的疗效。尽管在临床上应用针对T细胞特异性的治疗取得了一些成绩,但是仍然有一部分患者对治疗的反应和疾病的改善程度相对较差。例如,环孢素A是一种主要针对T细胞的治疗药物,临床上只有一小部分患者可以达到50%的改善。也许用于早期RA的治疗会有一定的作用,因为在RA的早期可以出现T细胞介导的损伤,此时使用针对T细胞的治疗或许可以收到更好的效果。
6.类风湿关节炎的动物模型 类风湿关节炎的动物模型为我们研究RA的病因、发病机制和治疗方法提供了有力的工具。自1892年Lucet首次描述了实验诱导葡萄球菌关节炎以来,动物模型逐渐被用来作为炎症性关节炎和退行性关节炎的研究对象。在控制动物子代繁殖的条件下,使在近交系中诱导慢性炎性滑膜炎成为可能。虽然一种动物模型只能模拟一种自身免疫病的全貌,但是,它们能够提供有关自身免疫性疾病的组织学、分子生物学和遗传学等方面的重要资料,而且,动物模型对研究新的治疗方法也有着重要的作用。作为理想的RA动物模型应该具备以下一些条件:①临床、病理和放射学的特点与人类RA相似;②尽可能少的具备非RA的特点;③这种疾病易感的动物品系容易得到,且价格便宜;④这种动物可以高效地繁殖;⑤可以缩短疾病的自然发生过程;⑥容易监测疾病和免疫功能的变化;⑦可以模拟RA患者对治疗的反应。
目前RA的动物模型有佐剂性关节炎(adjuvant arthritis,AA)、胶原性关节炎(collagen typeⅡ,CIA)、链球菌细胞壁成分(streptococcal cell wall fragments,SCWF)诱导的关节炎、蛋白多糖诱导的关节炎、姥鲛烷(pristane)诱导的关节炎、反转录病毒诱导的关节炎、乳酸杆菌属诱导的关节炎和支原体关节炎。虽然没有单一的系统可以反映RA,但是总的来说,动物模型在研究炎症的过程和各种抗炎因子的作用中起到了极为重要的作用。下面介绍几种重要的动物模型(表12)。
(1)胶原性关节炎:在大鼠、小鼠和非人类灵长类动物的易感品系,给予皮内注射混有完全弗氏佐剂的Ⅱ型胶原可以诱导关节炎的出现。这是Trentham等人于1977年在尝试培养胶原的抗血清参照物时偶然发现的。CIA在关节炎的动物模型中比较独特,因为它可以通过对正常的软骨蛋白而不是外源性异体抗原产生自身免疫反应而诱导疾病的发生。而且,给正常动物注射纯化的抗Ⅱ型胶原抗体可产生轻度的关节炎。在10~14天接受Ⅱ型胶原免疫的小鼠超过90%发展为多关节炎。在关节炎发生后的2周内,小鼠出现血管翳形成和血管形成(angiopoiesis),并导致关节软骨及骨组织的侵蚀和破坏。Ⅱ型胶原主要存在于透明软骨中,但也可出现在耳郭和耳前庭等关节外部位,这也可以解释Ⅱ型胶原的关节外效应。CIA的特点是可以产生抗Ⅱ型胶原抗体,并可发展为迟发型超敏反应。此关节炎是赖T细胞的证据包括:①胸腺缺如的动物不能诱导出关节炎;②给予抗T细胞或抗CD4辅助T细胞抗体可以抑制关节炎;③对Ⅱ型胶原特异的T细胞克隆可以传递疾病。
(2)链球菌细胞壁成分诱导的关节炎:Cromartie等人于1977年首次描述了链球菌细胞壁成分诱导的关节炎动物模型。典型的SCW关节炎是在一次给予皮内注射包含细胞壁肽多糖片段的水混悬液诱发的。一般动物于免疫后24h内,100%易感品系可出现外周关节的急性炎症表现,这主要是由于SCW片段沉积于滑膜中造成的。这个过程是非赖T细胞性的,而与补体的激活相关。一般持续3~5天。在免疫后2~3周内关节炎的症状可再次恶化,并持续数月。与第一阶段一过性的炎症不同,第二阶段的慢性滑膜炎是赖T细胞性的,病程中包括血管翳形成、血管形成、软骨与骨的侵蚀和关节的破坏。关节外的表现与RA类似,其中有小细胞性贫血、乏力和IL-2产生减少,但是SCW关节炎动物模型缺乏高滴度的类风湿因子,而且没有类风湿结节的形成。SCW关节炎对NSAID、环磷酰胺、甲氨蝶呤和糖皮质激素有反应,但是对金制剂和青霉胺的反应差。
(3)佐剂性关节炎:Pearson于40年前首次描述了佐剂性关节炎。一次给予皮内注射一种包含热杀死结核分枝杆菌、M.phlei或M.butyricum混于油中的混悬液通常可诱发关节炎。像SCW关节炎一样,与遗传因素相关的动物的种属和品系十分重要。佐剂中结核杆菌的65kD应激蛋白可能是致病抗原,它与软骨中的蛋白多糖桥联蛋白抗原成分相似。而且在人及AA大鼠的关节软骨和滑膜结合处均发现有类似的内源性应激蛋白。佐剂性关节炎的炎症过程是赖T细胞的。与该病相关的临床特点包括关节受到侵蚀、关节强直、体重减轻、食欲减退、
脾大、白细胞增多、发热、急性期反应物增高、肌
腱炎、皮疹、
前葡萄膜炎、虹膜睫状体炎、角膜炎、
尿道炎和
腹泻等(表13)。
缺点是发病快、病程单一,对研究那些反复作用于疾病的因素带来一定的困难。此外,CIA的动物模型中,出现的关节强直和骨质增生更倾向于赖特综合征的表现。
佐剂性关节炎在RA中的作用:①利用该动物模型研究RA的病理生理学包括自身免疫现象和关节的破坏;②用于识别参与自身免疫性疾病的基因,以及寻找可疑基因。
近来,Griffiths和他的同事利用CIA动物模型,发现了4个与关节炎症严重程度相关的新的数量性状基因座,其中有令人感兴趣的候选基因,如前列腺素合成酶、补体C5、PDGF、VEGF和肿瘤坏死因子家族成员等。而且,发现了一个新的数量性状基因座(Ciaa3),它参与抗胶原抗体的产生。
7.病理 类风湿关节炎的病变主要发生在关节腔,有些病人伴有关节外表现(图6)。其病理特点是:①炎症细胞浸润,甚至淋巴滤泡形成;②血管炎;③类风湿性肉芽肿形成。
(1)正常关节组织:滑膜是衬在关节囊内面的一层组织,它并不覆盖关节软骨,其表面被A细胞和B细胞各一层所覆盖,据认为A细胞是由个体发育初期固定在该处的巨噬细胞衍变而来,其下面是一层由成纤维细胞衍变来的B细胞。B细胞下面有丰富的毛细血管和细静脉,它们的通透性很高。再下面是以脂肪为主的结缔组织。A细胞有很小的细胞突起,含有丰富的溶酶体,内噬性作用很强,能够清除腔内衰老组织。B细胞表面有丰富的圆形或椭圆形小胞体,能产生胶原、纤维粘连蛋白、层粘连蛋白和透明质酸等基质,起润滑和缓冲作用。同时也具有大量基质合成酶和基质分解酶。血管供给能量,兼有供排水功能。
关节软骨附着于软骨下骨的表面。软骨由软骨细胞和软骨基质构成,软骨细胞合成及分泌基质。基质主要由Ⅱ型胶原、蛋白多糖和水组成。关节软骨无血管和淋巴,它们是通过滑膜液摄取营养的。
(2)滑膜炎症反应:
①衬里细胞层增厚:类风湿关节炎的滑膜衬里细胞从正常的1~2层增厚到8~10层。两类细胞数量均增加,但以A型细胞增加为主。增生的A、B细胞均被活化,高度表达激活抗原。
②新生血管和炎性细胞浸润:类风湿关节炎滑膜的微血管数量显著增加,新生的血管主要为毛细血管及具有高柱状内皮细胞的毛细血管后微静脉,后者在滑膜深处。这些高柱状内皮细胞高度表达多种细胞黏附分子和细胞因子。大量淋巴细胞聚集在血管周围,其中以CD4 T细胞为主,少量CD8 T细胞,形成滤泡样结构。可见少量B细胞在滤泡中心,但大量浆细胞散布在淋巴滤泡周边或之间。巨噬细胞分布在整个滑膜。少量树突状细胞散在于淋巴滤泡中和衬里细胞层。类风湿关节炎滑膜内各类细胞均表达MHCⅡ类分子,其表达的水平显著高于正常人的滑膜。
③血管翳的形成:由于滑膜衬里细胞增厚、新生血管、大量炎症细胞浸润、淋巴滤泡形成,使滑膜发生绒毛样增生,增生的滑膜形成血管翳突入关节腔内。
(3)软骨和骨的破坏:类风湿关节炎关节软骨的破坏开始于滑膜与软骨的交接处。此处滑膜增厚,血管、细胞成分显著增多,形成血管翳并自关节软骨边缘处逐渐向软骨面伸延,构成血管翳/软骨结合。血管翳中增生的A、B型细胞及浸润的炎症细胞分泌蛋白酶(主要是基质金属蛋白酶)、细胞因子(IL-1和肿瘤坏死因子-α等)和其他炎性介质,破坏相邻的软骨,使软骨细胞分泌基质减少,胶原和蛋白多糖被基质金属蛋白酶破坏,破骨细胞被激活,最终导致关节软骨和骨的破坏。
(4)关节腔积液(图7):正常关节腔内有少许滑膜液,膝关节滑液不多于3.5ml,呈草黄色,清亮透明,含有少量白细胞,起润滑关节作用。类风湿关节炎病人关节腔可出现大量积液,尤其在急性期。积液中含有大量炎症细胞,主要为中性粒细胞,还可见到大量T细胞,少量的单核/巨噬细胞、树突状细胞和B细胞。可测到多种细胞因子及可溶性受体。
 治疗
治疗
治疗:
1.治疗概述 本病至今无特效疗法。治疗主要是缓解疼痛,改善关节功能,减少复发,尽可能控制疾病的发展和预防畸形。全身症状严重及关节肿胀时应卧床休息,至症状基本缓解为止。但对急性期已过而关节仍疼痛者则不必终日卧床,以免关节废用而变为僵硬。只要病人可以耐受,即应早期有规律地作主动或被动的关节锻炼活动。应教育病人避免反复感冒或感染,以免加重病情。指导病人合理用药,以防机体免疫力降低使病情恶化。另外,还必须给病人说明避免过度疲劳、充分防寒及保持居所干燥,不得长期居住潮湿房间等。
随着临床检测和研究技术的发展,人们对类风湿关节炎的了解越来越深入,同时也推动了治疗的迅速发展。从传统的非类固醇抗炎药到细胞毒药物和免疫抑制剂,再到作用于炎症特殊环节的生物制剂,以及最近尝试的外周血干细胞移植和基因治疗。类风湿关节炎治疗的策略也随着人们认识的提高发生了重要的转变,而这个转变过程也从一个侧面反映了循证医学对现代医学发展所起的作用。
类风湿关节炎(rheumatoid arthriris,RA)是一种慢性系统性炎性疾病,是外周关节滑膜炎为主要表现。发病后的平均病程是27年,其临床表现从关节症状到关节外表现,可轻可重,因人而异。但是几乎所有的病人都会遭受关节疼痛之苦,几乎所有的病人都会有关节功能不同程度的丧失。类风湿关节炎还会带来严重的社会问题,例如发病初期可以工作的病人,10年后有35%~50%将丧失工作能力,而20年后将升至50%~70%。同时,RA病人的心理健康和生活质量也较普通人为差。因此国外将此类疾病描述为“5D”,即不适、抑郁、残废、死亡和花费钱财(discomfort、distress、disability、death和dollar lost)。
传统的治疗方案称为金字塔疗法,治疗一般从金字塔塔底开始。早期,由于人们对RA的认识不足,只能从减轻病人症状入手进行治疗。20世纪40年代到60年代,治疗RA使用最多的药物是阿司匹林。到70年代,一些新研制的非类固醇抗炎药物(NSAIDs)得到了越来越多医生的认可。当时认为早期RA是单纯的炎症反应,为可逆性的,单独使用抗炎治疗已足够。只有当体检或X线检查发现关节破坏明显时,才使用慢作用药物。金字塔疗法流行了近50年。在20世纪90年代以前,风湿病学家和临床医生把大部分注意力都集中在发现和防止治疗药物的副作用上,而较少关注药物对疾病本身严重后果的阻止。当时有一种流行的说法:如果你不能使病人实际情况变得更好,至少不该使之变得更坏。
从20世纪的最后十年开始,风湿病学家对RA治疗的观点发生了深刻的变化,同时类风湿关节炎的结局也越来越好。这一时期甲氨蝶呤MTX的广泛接受是产生这种变化最重要的因素之一,其他包括改变病情药物(DMARDs)的早期使用以及联合治疗。这些药物之间或产生协同作用,或作用于疾病病理生理过程不同的环节,使得总体的副反应降低。随着近年来生物制剂(如抗肿瘤坏死因子-α制剂和抗IL-1Ra制剂等)的出现,RA的治疗又发生了一场新的革命。总之,治疗上的变化使我们能够更合理地使用现有的治疗手段,从而更好地改善RA的结局。
多年来,风湿病学家从大量关于RA的临床研究中总结出:①没有一个单独的治疗方法可以获得临床的显著或持续缓解,或阻止关节结构和功能丧失的进程;②一部分病人很早发生关节软骨的不可逆丢失,在病程早期M
RI可以发现关节侵蚀,其敏感性要大大优于普通关节平片;③治疗的副反应和并发症可以增加病人的死亡率;④惟一可以用来预测发生严重关节炎侵蚀或关节外病变的参数是一个共享表位,即Ⅱ型MHC的HLA-DRB1链上第3个高度可变区的QKRAA氨基酸序列;⑤临床上可以用来有效地预测预后的方法有:健康评估问卷(HAQ)或其改良形式(MHAQ)、功能测试、急性期反应物(ESR和CRP等)和类风湿因子(RF)的水平;⑥顺势疗法并不优于安慰剂治疗。
2.对类风湿关节炎病情的评估
(1)病情评估的重要性:类风湿关节炎是一种慢性病,可以在儿童至老年之间的任何时期发生,通常伴随终生。不同RA患者的病情好比指纹,尽管每个人都有相似之处,但没有两个病人能够完全一样。根据患者病情的进展、发病时的年龄和生活状态、炎症对目前生活的影响、躯体功能的下降、工作能力的丧失程度、特殊关节的破坏及社会和心理的处理能力,不同病人在治疗的具体目标上有所不同。在治疗过程中,临床医生所遇到的另一个挑战就是对每一位患者的具体情况作出综合的正确评估,并制定相应的治疗计划,而这必须得到多学科(如风湿病学、外科学和康复医学等)的配合和患者的认同。了解患者的意愿也非常重要,尽管这样做有时需要医生付出较多的时间。让患者了解目前自己的病情和可能的预后,以及治疗可能发生的不良后果,可以使其明白治疗的合理性和必须性,并让其自己评估在治疗获得症状改善的同时需要承担何种程度的危险。在对病情进行评估和分析预后之前需要了解下列几个名词的含义。
①病情活动性:指RA全身和局部的炎症表现,其主要的临床表现是滑膜炎。一些临床指标可以用来评估疾病的活动性,如:肿胀关节数、压痛关节数、病人对疼痛和总体严重性的评估、功能障碍的评估和急性期反应物(ESR和CRP)。美国风湿病学会和欧洲抗风湿联盟都有各自对疾病活动度评估的方法,但是在临床实际工作中的应用并不方便。RA的其他临床表现如血管炎等,通常不常规用于对病情的评估。
②病情严重性:病情严重指:A.疾病的活动性持续处于较高水平;B.明显的关节结构损坏、功能丧失、工作能力丧失、放射学异常和需要关节置换;C.病情迅速恶化并有可能产生显著的关节结构破坏和其他负面的结果。
③病情活动性和疾病转归之间的关系:病情活动性和病人目前的临床表现相对应,如果病情活动性持续处于高水平,则会带来不良的后果。病情活动性越强,则不良结局发生的危险越大,并且在短期内即可产生,所以病情活动性很强的情况被认为是临床急症。在这里需要强调的是,即使病情活动性较弱,也会引起功能丧失,造成严重的生活限制,所以不能将对疾病的耐受和疾病的低活动性与良好的远期转归相混淆。
为了使评估方法含有足够的信息同时又能迅速完成,一些学者建议评估方法至少应包含一种关节计数方法、ESR或CRP、疼痛和(或)疾病严重性测评、一种疲劳对照表和一种功能评估(HAG或MHAQ),可以使用的方法有关节炎和生活指数或临床健康评估问卷。有学者认为从关节压痛和肿胀所获得的信息与新的影像技术如M
RI和超声相比显得不足,因此使用这些标准有时不能达到预期的目标,但是在特定的情况下使用已经足够了。例如,对于那些疾病呈进行性发展的病人,尤其是有可能要进行手术的病人,医生应对其进行关节计数。thompso指数(改良的lansburg指数)使用相对较少的关节数,对于评估“滑膜负荷”很有用。也有的学者认为影像学对于评估具体病人的情况作用较小,其理由是:A.不同的临床医生对同一张影像会有不同的看法;B.软骨破坏和出现影像学异常之间有一段时间间隔;C.影像学改变和病人关节功能的变化之间联系不强。但是对于同一个病人来说,定期进行影像学比较,对了解病情变化还是有帮助的。有研究发现
血浆YKL40即人类软骨糖蛋白39(gp39)的浓度可以作为疾病活动的标志,比传统的ESR和CRP好,但这个结论还需要得到进一步证实。
(2)类风湿关节炎治疗前的基础评估:理想的评估方法应该“敏感、可信、正确、切实可行、全面而不繁冗”。传统认为,对一个RA患者病情的准确评估来自于关节计数、握力、行走时间和实验室检查包括影像学检查。美国风湿病学学会在《类风湿关节炎治疗指南2002版》中推荐,在开始治疗之前对患者进行基础评估(baseline evaluation)(表16):
(3)类风湿关节炎病情活动的评估:每次患者就诊时,临床医生必须评估病情是否活动及活动程度,以此决定治疗的方案(表17)。
这里介绍美国风湿病学学会推荐的测量疾病活动性的核心标准和疾病活动分数(DAS)计算法。
①美国风湿病学学会推荐的测量疾病活动性的核心标准:
A.压痛关节数:记录查体时压迫和操纵28个关节的压痛关节数,应检查压痛的不同方面,但只记录有无压痛。
B.肿胀关节数:评估28个或更多关节的肿胀情况,只记录肿或不肿。
C.患者对痛的评价:用视力对照表(通常10cm)或Likert分级评估目前疼痛水平。
D.患者对疾病活动性的总体评价:用AIMS提问写出目前情况,应提供一个视力对照表(10cm),也可用Likert分级。
E.医师对疾病活动性的总体评价:用视力对照表及Likert分级,并由医师记录。
F.患者对体力功能的评价:可用的有AIMS、HAQ、MHIQ、MACTAR等。
G.急性期反应物水平:魏氏法测血沉或C反应蛋白。
H.疾病活动分数(DAS)计算法:
DAS=0.54() 0.065(SwJ s) 0.33(lnESR) 0.0072(GH)
RAI:Ritchie关节指数。
ESR:红细胞沉降率。
SwJ s:肿胀关节数目。
GH:通过100mm视力对照表进行的一般健康状态评估。
DAS判断标准:
低度活动DAS≤2.4;治疗反应良好△DAS>1.2
中度活动2.4<DAS≤3.7;治疗反应一般0.6<△DAS≤1.2
高度活动DAS>3.7;治疗无反应 △DAS≤0.6
△DAS=治疗后DAS-治疗前DAS
②美国健康评估问卷(HAQ):
A.穿衣及洗刷:你能从衣柜及抽屉内取出衣服吗?你能自己穿衣包括扣纽扣、拉链、扣衣钩吗?你能洗头发吗?
B.起立:你能从坐椅上起立不用手支撑吗?
C.进食:你能切肉块吗?你能举一满杯水到你嘴吗?
D.走路:你能到室外平地上走路吗?
E.卫生:你能洗全身并擦干吗?你能用澡盆洗澡吗?你能开关自来水龙头吗?你能去厕所坐马桶并从马桶上起立吗?
F.达距:你能梳头发吗?你能把在你头上面5磅的东西取下来吗?
H.握力:你能开关门吗?你能打开过去已经开过的罐子吗?你能用铅笔或钢笔吗?
I活动:你能开汽车吗(排除非关节炎原因及不开车)?你能上街办事或购物吗?
J.性生活:你能有性生活吗(或无性伴侣)?
说明:以上每个提问选答无困难(0)、有困难(1)、需要别人帮助(2)、不能做(3)。
性生活选答无困难(0)、有些不舒服(1)、只限于某个姿势或很不舒服(2)、因关节炎而不可能(3)。
将各项指数累积再除以项目数,得到的平均数即当前的健康指数。
(4)类风湿关节炎病情改善的评估:
①ACR病情改善评估:在临床试验中评估RA病情的改善可以用美国风湿病学学会推荐的RA改善标准,包括评估:A.肿胀关节数;B.压痛关节数;C.急性期反应物(ESR和CRP);D.疼痛度(使用目测对数表VAS);E.VAS疾病严重性综合评估;F.功能评估(通常使用健康调查评估问卷)。如果病人至少在4个方面改善了20%、50%或70%,则可以说此病人达到ACR20、ACR50或ACR70改善标准。由此可以看出,ACR标准的特征是它能够检测病情的变化。
②Van der Heije评估:由Van der Heije及其同事发明的评估方法,在欧洲被广泛使用。此法中,肿胀关节数、压痛关节数、ESR和病人对病情的综合评估被认为是最好的评估因素,在此基础上算出疾病活动分数(DAS),所以DAS是以患者的绝对状态为基础。
(5)类风湿关节炎预后的评估:病情评估是为了了解疾病发展到何种阶段,同时判断治疗效果和进一步的治疗方案,而预后则是对转归作出预测。对临床工作者来说,在较短时间内使用尽可能少的实验室数据对疾病的转归进行预测也是很重要的。一项对早期RA长达6年的研究表明,在1年内有显著指导预后价值的是基础疾病活动性(包括晨僵、疼痛、握力、关节计数、血红蛋白和ESR)和类风湿因子阳性。功能性结局比影像学和实验室数据更能有效地预测远期转归。有人根据疾病的不同阶段判断预后(表18)。
一些研究发现,在HL
ADRB1链上具有1个或2个共享表位的RA病人对甲氨蝶呤单剂的反应相对弱,临床观察也发现这类病人最易发生病情的进行性恶化,所以需要更早更积极的治疗。应用此类基因分析可望促进对不同个体进行早期有效的治疗。在一个利用
Gd-DTPA进行的增强M
RI研究中发现,M
RI所显示的关节侵蚀速度与滑膜容积高度相关,而且M
RI所显示的骨侵蚀往往经过1年后才能在普通放射学检查中发现。因此,研究人员预言RA中的滑膜炎多在普通炎症标记物正常时进展加重的。这种滑膜炎由于极易对软骨和骨产生破坏而被视为类似于局限于关节部位的恶性疾病。
(6)类风湿关节炎的生化评估指标:最近的研究发现很多生化标记对诊断、判断病情和预后有很大的帮助(表19),由于这些标记物的意义并未完全阐明,而且检测技术要求较高,故在实际应用中受到限制,但这也预示着未来的发展方向。
3.非类固醇抗炎药物 历来都是将治疗RA的药物分为一线药物和二线药物,一线药物指非类固醇抗炎药(non-steroidl anti-inflammatory drugs,NSAIDs),二线药物指改变病情药(disease-modifying anti-rheumatic drugs,DMARD),也称慢作用药(slow acting drugs)。之所以有这样的分法,是因为最初人们在治疗RA时发现NSAID可以非常迅速而有效地缓解关节炎的症状,而DMARDs产生作用很慢,并且副作用很大,故将NSAID作为治疗RA的首选用药。随着人们对RA认识的深入,发现NSAID并不能保护骨关节不受损害,反而是DMARDs可以减慢骨关节破坏的进程。从此,RA的治疗方案也变成以DMARDs为主,NSAIDs成为帮助缓解症状的辅助治疗(adjunctive therapy)药物。从这个层面上讲,传统的一线和二线药物的分法已经失去了原来的意义。起初的“一线”药物反而要退居二线,而起初的“二线”药物成为治疗RA的核心。
其实,对于一位有多关节痛的患者来说,在诊断前后都需要使用减轻关节疼痛的药物,尤其是在诊断前,常用3类药物:止痛药、
NASIDs和糖皮质激素。止痛药指对乙酰氨基酚,它单纯用于解热镇痛,而几乎无抗炎作用。当诊断RA之后,治疗以DMARDs为主,并且在控制病情后,逐渐停用上述3类药物。
(1)对NSAIDs治疗作用的认识过程:非类固醇抗炎药包括一大类药物,这类药物具有解热镇痛抗炎的作用。一般情况下它们起效较快,小剂量主要是解热镇痛,较大剂量则有抗炎作用。它们能够减轻炎症的症状和体征,但是并不能消除产生炎症的原因。尽管NSAID对各种形式的关节炎都有抗炎作用,但它们对基础疾病的进展没有作用,也就不能对受损的关节和软组织起保护作用。临床观察亦表明,单独使用NSAID进行长期治疗并不能阻止骨关节的破坏进程。
第一阶段是1971年,Vane提出NSAID的主要毒性和治疗效果可能归因于此类药物抑制环氧酶(cyclo oxygenase,COX)产生前列腺素的能力。
第二阶段是1990年,Masferrer等指出可能存在分别由不同基因编码的环氧酶池。随后很快分离、克隆得到COX-1和COX-2两种同工酶的互补D
NA(cD
NA),并在体外表达。研究发现COX-l是结构性环氧酶,主要介导生成生理性前列腺素,属于细胞的正常功能;而COX-2是诱导性环氧酶,由内毒素、炎症因子及组织修复的刺激因子作用所诱导。这一结果帮助解释了NSAID在抗炎效果和胃肠道副作用之间的联系。于是出现了COX-2抑制剂,尤其是20世纪的最后十年,COX-2抑制剂在RA的治疗中掀起不小的轰动效应。
一直以来,COX-1被认为是一个基本的“管家酶(housekeeping enzyme)”,存在于很多组织中,负责胃黏膜、内皮、血小板和肾脏中生理性前列腺素的产生,这些前列腺素具有保护细胞和维持稳态的作用。NSAID很多的副作用与COX-1受到抑制相关。
而一般情况下非激活细胞不产生COX-2。正常状态下COX-2存在于某些细胞中,如脑组织、脊髓、肾脏、胰腺、肺脏和胃,并保持极低的水平,但是它在这些脏器里确切的功能还不十分清楚。白细胞、血管平滑肌细胞、关节滑膜细胞和大脑神经元,只有在分裂素、细胞因子和内毒素等刺激诱导下,才生成COX-2,并催化前炎性前列腺素的合成,所以COX-2属于诱导酶。炎症反应时,体内产生大量的COX-2远远超出了正常水平。目前动物模型证实,COX-2与角义(菜)胶诱导的炎症、炎性疼痛和发热有关。在动物的脑组织中,COX-2与神经源性疼痛和发热有联系。在鼠的结肠炎模型中与黏膜损害和幽门螺旋杆菌联系的消化道溃疡的愈合有关。COX-2也参与一些正常的生理过程,例如,生殖过程中排卵和胚胎细胞的着床、骨的重建;COX-2可在肾小球足状突细胞和肾血管内皮细胞内表达,受抑制后可以产生暂时的水钠潴留,血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)可使其表达上调。所以抑制COX-2也可产生相应的不良反应。
第三阶段是20世纪末,研究人员提出了对COX的重新认识。近期研究发现,在RA患者的滑膜组织中测出COX-1和COX-2,在体外培养的类风湿滑膜细胞显示巨噬细胞、成纤维细胞、内皮细胞及单个核炎性细胞均表达二种酶。敲除COX-1的小鼠能减轻对花生四烯酸的炎症反应,而敲除COX-2的小鼠经炎性刺激同样可出现炎症反应,且其反应程度与对照鼠无明显差异。说明COX-1不仅是管家酶,也是诱导酶,它参与炎症,并有加重炎症的作用;而COX-2尽管与炎症有关,但抑制其作用未必不出现炎症反应。
COX-1既作为管家酶参与维持生理过程,也作为诱导酶参与炎症反应;反之,COX-2作为诱导酶参与炎症,也作为管家酶有重要生理活性,因此,可以认为2种同工酶有功能上的重叠及作用上的互补,共同对机体发挥保护作用(图42)。
NSAIDs的药理作用还有其他机制。在适当的条件下,NSAIDs能够解除氧化磷酸化作用,能够从
血浆蛋白置换出内源性抗炎肽,抑制溶酶体酶的释放,抑制补体激活,拮抗激肽的生成和活性。在体外严格控制的条件下,NSAIDs抑制磷酸二酯酶,可增强PGE1介导胞内环
腺苷酸增加的能力,从而抑制前炎性细胞的功能,抑制外周血淋巴细胞对分裂素刺激的反应,抑制中性粒细胞和单个核细胞的聚集,抑制中性粒细胞的功能。NSAIDs的这种作用可以出现在不含有COX的细胞,并且不受前列腺素的影响。NSAIDs通过阻断正常的激活信号,从而抑制炎性细胞的激活。NSAIDs可能还清除自由基,抑制多形核细胞产生超氧化物,抑制单核细胞
磷脂酶C的活性,以及抑制NO合成。
(2)NSAIDs的分类及作用特点:
①NSAIDs的分类:一直以来NSAIDs的分类是根据化学组成和
血浆半衰期进行的,最近建议按照它们对COX-1/COX-2抑制的活性进行分类。国际COX-2研究组建议将NSAIDs分为下列4种类型:COX-1特异性、COX非特异性、COX-2优先和COX-2特异性。COX-1特异性抑制剂指药物主要抑制COX-1,临床上不产生可检测的COX-2活性抑制作用。小剂量的阿司匹林是惟一属于此类的药物。COX非特异性抑制剂指药物对COX-1和COX-2的抑制能力在临床上没有显著差别。大部分的NSAIDs都属于此类。COX-2特异性抑制剂指药物在最大治疗剂量时也不产生对COX-1的抑制作用。一般情况下,此类制剂在体外抑制COX-2的能力要比COX-1强100倍以上。目前这类制剂有
塞来昔布(celecoxib)和
罗非昔布(rofecoxib)。COX-2优先指在临床上抑制COX-2产生的抗炎和镇痛作用时并不显著抑制COX-1的一类制剂,但是在大剂量时可以产生对COX-1的抑制作用。因此它们抑制COX-2和COX-1能力的差别介于非特异性COX抑制剂和COX-2特异性抑制剂之间,主要有美洛昔康(meloxicam)、尼美舒利(nimesulide)和
依托度酸(etodolac)。大部分这类药物在体外抑制COX-1和COX-2的能力相差2到100倍。由于不同的患者临床反应不同,有时药物的效果难以预料。对所有的患者规定一个统一的剂量也比较困难,因为可能某一剂量并不能产生最佳的抗炎和镇痛效果。
②NSAIDs的作用特点:于治疗RA的NSAIDs都有抑制炎症的作用。药物吸收后可以很快消除关节红、肿、热、痛,并改善关节功能。一般NSAIDs对实验室检查如类风湿因子、血沉、CRP、
血浆白蛋白等不产生影响。足量的NSAIDs对RA病人在DMARD治疗期间出现的关节痛、肿、压痛和晨僵也有益处,不过在NSAIDs撤药后症状又可以很快复发。不同NSAIDs的最大抗炎能力几乎相同,与组织在有效药物浓度中暴露的时间有关。因此,剂量越大,
血浆半衰期越长,临床上易于达到最大效果。但是,对选择性COX-2抑制剂而言,随着剂量的增加,其效果将达到一个平台,剂量再增加其抗炎效果也不会显著增加。事实上,所有的NSAIDs在以小于抗炎剂量使用时,都能缓解疼痛。NSAIDs的镇痛作用一般被认为是外周性的,近年的研究表明,选择性COX-2抑制剂也可以阻止中枢神经系统和脊髓中疼痛的传输以及对痛性刺激的感知。各种NSAIDs镇痛的能力有一定的差别,
氯诺昔康是一种比较新的NSAIDs,其镇痛效果被认为强于同类药物。尽管临床试验证明各种NSAIDs达到最大有效剂量后效果相似,但是不同的病人对不同的药物反应不尽相同,这可能与药物的代谢、病人对药物的耐受性和病人的个体差异有关。NSAIDs不同药物的剂量和半衰期比较见表20。
一般情况下,最大临床效果出现在NSAIDs给药后7~10天内,如果足量后仍然不能产生满意的效果,则要考虑换用其他NSAIDs或换用糖皮质激素。
(3)NSAIDs的副作用:
①传统NSAIDs的副作用:
A.胃肠道症状:此类药物本身对胃肠道有直接的刺激作用,加上影响前列腺素的合成,黏膜保护机制受到破坏,故容易出现胃肠道黏膜糜烂、溃疡,乃至出血。症状有恶心、呕吐、黑便和消化道出血。为了减轻或防止NSAIDs对胃肠道的副作用,可嘱病人餐后服药,以减少对胃黏膜的刺激。NSAIDs引起胃肠道并发症的危险因素有:a.老年人;b.有胃溃疡病史(伴或不伴幽门螺杆菌感染);c.正在服用糖皮质激素或抗凝药;d.有血小板减少或血小板功能障碍;e.妊娠女性;f.有中度或重度心力衰竭、肝硬化或肾功能不全;g.有阿司匹林过敏、哮喘和鼻息肉病史。
胃肠道事件(因为发生胃肠道副作用而需要住院治疗或死亡)积分表(表21)可以帮助判断是否使用抑酸药,如果计算的危险率超过1.5则需要进行胃肠道保护。COX-2抑制剂与传统的NSAIDs比较,能够明显降低胃肠道副作用的危险性。
B.肾毒性:老年及肾功能减退是此类药物引起肾脏副作用的危险因素。NSAIDs可以抑制肾内具有扩血管作用的前列腺素,使肾内血流减少而受损。NSAIDs对大多数病人的肾功能影响都不大,部分病人在使用此类药物后,可有血清肌酐的升高。NSAIDs对肾脏的另一类损害是一种特发性反应,可以引起大量蛋白尿和急性间质性肾炎。
C.抗凝作用:NSAIDs抑制血小板的COX-1,从而抑制血栓素A2的合成,影响血小板的聚集。
D.肝毒性:NSAIDs可以使转氨酶升高,但大多较轻。
E.其他:皮疹、哮喘也可以发生。NSAIDs可以对骨髓产生抑制,从而引起粒细胞缺乏和再生障碍性贫血,这种副作用可以是致命的,但不多见。
保泰松最容易产生这样的副作用,使用时尤其要注意。
②选择性COX-2抑制剂的副作用:
A.胃肠道症状:选择性COX-2抑制剂也有胃肠道症状,尤其是经常出现消化不良。不过有关选择性COX-2抑制剂的长期研究数据表明,选择性COX-2抑制剂抗炎效果与传统的NSAIDs相似,但具有较好的胃肠道安全性,可以将胃肠道并发症的危险率降低一半。一些前瞻性双盲对照临床试验显示,内镜证实的胃黏膜侵蚀和溃疡的发生率在选择性COX-2组和安慰剂组相似,并且要大大低于萘普生和布洛芬组。但是,除安慰剂组外,其余试验组在恶心、消化不良和腹痛这些症状的发生率上没有显著差别。因此,选择性COX-2可以显著减少NSAIDs带来的严重和致死性副作用,但不能明显改善它们的胃肠道耐受性。
B.肾毒性:最新的研究资料表明,COX-2对调控肾功能也有重要的作用,选择性COX-2抑制剂对肾功能的影响与传统药相似。研究发现,
罗非昔布与吲哚美辛引起肾小球滤过率降低方面很相似。在多剂量研究中,与安慰剂组比较,用
罗非昔布12.5mg/d治疗6
天可使肾小球滤过率降低0.14ml/s,25mg/d则降低0.13ml/s;吲哚美辛50mg3次/d,每天使肾小球滤过率下降0.1ml/s。因此,使用传统NSAIDs时采用的肾功能保护措施在服用选择性COX-2抑制剂时也需要考虑采用。
C.抗凝作用:选择性COX-2抑制剂不能对血小板的黏附和聚集产生影响,所以在需要抗凝的情况下不能代替阿司匹林。甚至有报道,与传统的NSAIDs相比,使用选择性COX-2抑制剂具有更高的血栓事件(包括心肌梗死和脑卒中)发生率。
D.其他:在血管内容量减少或出现水肿时,如充血性心力衰竭、肾病综合征或肝硬化,或血肌酐水平≥2.5mg/dl,要避免使用NSAIDs和选择性COX-2抑制剂。有资料表明,COX-2抑制剂能够引起下肢水肿和高血压。如同上文所说的,基础研究表明COX-2在正常的生理过程(例如骨形成、排卵等)中、在机体对应激的某些反应和一些病理过程中具有更大范围的作用。例如,在生殖生理、神经的功能、特殊的病理生理状态像阿尔次海默病(Alzheimers disease)和结肠直肠肿瘤中,COX-2都有一定的作用。因此,单纯抑制COX-2带来的有益或不利的影响还需要进一步的研究。
4.几种新型的NSAIDs制剂:
(1)
氯诺昔康Lornoxicam(商品名:可赛风
Xafon):
氯诺昔康亦称氯
替诺昔康,是昔康类非类固醇抗炎药的一种。口服吸收迅速,呈剂量线性关系,吸收很完全,达峰时间平均1~2h,平均半衰期为3.5~4.5h。进入体内的
氯诺昔康约99%与蛋白结合,血药浓度尽管在停药后迅速下降,但关节液中浓度却可保持相对恒定。
氯诺昔康在肝脏中被代谢成完全无活性的5-羟基
氯诺昔康,约1/3从尿和约2/3从胆汁中以代谢物的形式被完全排泄。同等剂量的栓剂与静脉注射剂相比,前者生物利用度只有后者的65%~74%,所以直肠给药时剂量应该增加。食物可以使
氯诺昔康的吸收减少20%,因此
氯诺昔康应空腹服用。重复给药并不会在体内产生蓄积,这是因为该药半衰期很短。
氯诺昔康在老年人中也不产生蓄积,在肾功能衰竭的病人中其药代动力学特点基本不变。
氯诺昔康在12~16mg/d剂量下可以在肝功能受损病人产生轻度蓄积,但8mg/d剂量时药代动力学参数与对照组无显著差异,因此除非肝功能损害严重,否则不需要减少药物剂量。
氯诺昔康与其他非类固醇抗炎药一样,其镇痛和抗炎作用是通过抑制环氧酶(COX)活性,从而抑制前列腺素合成来实现的。
氯诺昔康对于COX-1和COX-2具有同等强度的抑制作用。因为它不抑制5-酯氧化酶活性,所以不抑制白三烯的合成,也不改变花生四烯酸向5-酯氧化酶的转化途径。
NSAIDs药物在类风湿关节炎中的应用主要是为了缓解急性期炎症和镇痛,它们并不能改变RA的病程。
氯诺昔康虽然具有潜在的减少关节破坏的作用,但是这种作用还没有在临床中得到证实。该药的优点在于它的抗炎和镇痛作用较强,口服给药1h、肌注25min后即可产生作用,且作用可维持8h以上。
氯诺昔康的镇痛作用尤其让人瞩目,在手术、癌症、腰背痛和其他疼痛方面有着广泛的应用。已经有很多临床实验对
氯诺昔康在RA中的疗效进行了观察,这些观察确认了
氯诺昔康的量效关系,即4mg 3次/d或8mg 2次/d比2~4mg 2次/d有效。治疗过程中疾病的活动性没有显著改善。
迄今为止,在参加
氯诺昔康临床试验的4349例病人中,其总的不良反应发生率为24.9%。胃肠道症状最为常见,症状大多数为消化不良、腹痛、恶心、呕吐和腹泻,消化道溃疡的发生率是0.5%。胃肠道不良反应的发生与剂量相关。长期治疗时,老年人和女性病人出现胃肠道不良反应的危险并不增加。因为
氯诺昔康一方面血药浓度下降很快,而在关节中浓度维持较长;另一方面因
血浆消除半衰期短,可以让保护胃黏膜和保持肾血流量的前列腺素水平在两次给药之间达到正常,所以胃肠道损害比其他非类固醇抗炎药要小。另外,还有肾脏、肝脏、神经系统、皮肤反应等不良反应的报道,不过发生率极低。在接受治疗剂量3周至长达1年以上的病人中,不良反应的类型也相似。大多数不良反应都在开始用药后第1个月内出现。总之,
氯诺昔康在4~16mg剂量范围内长期使用是比较安全的。
氯诺昔康与其他药物之间的相互作用与其他非类固醇抗炎药类似:①与抗凝药或抑制血小板聚集药合用可以增加出血危险;②增强磺酰脲的降糖效果;③降低利尿剂利尿作用和降压效果;④增强锂剂毒性;⑤甲氨蝶呤可以增加
氯诺昔康血药浓度;⑥西咪替丁可提高
氯诺昔康血浆浓度;⑦地高辛可轻微降低肾脏对
氯诺昔康的清除。
氯诺昔康在下列情况中不应使用:①已知对非类固醇抗炎药有过敏反应;②有急性胃肠道出血或急性胃十二指肠溃疡史;③具有不明原因的造血系统疾病;④妊娠女性;⑤无医生指导的哺乳期妇女;⑥无医生指导的婴儿、儿童和18岁以下的青少年。
在下列情况中使用
氯诺昔康应该慎重考虑:①消化道出血或消化道溃疡引起的贫血;②具有产生血栓的可能;③肾功能受损(血肌酐>140μmol/L)或目前具有影响肾功能的其他因素者,例如肾小球肾炎或糖尿病肾病;④对
水杨酸或其他抗炎镇痛药不耐受。
总之,
氯诺昔康是一种强有力的镇痛抗炎药。治疗RA也是使用其抗炎镇痛的药理作用,尤其在镇痛方面,它可以替代大剂量的其他非类固醇抗炎药和中等剂量的阿片类药物,而且相对耐受性良好。因此可以作为改善RA症状的较好药物。
(2)美洛昔康(meloxicam):美洛昔康优先抑制COX-2。该药物到达滑膜液的浓度是
血浆浓度的4%~50%,但其游离形式在滑膜液和
血浆中浓度相似。美洛昔康主要通过细胞色素P450-2C9代谢。药物的总清除率是7~8ml/min,清除半衰期是15~20h。肝功能受损和轻度到中度的肾功能损害不影响美洛昔康的药物代谢。美洛昔康对地高辛、呋塞米、小剂量甲氨蝶呤和华法林的药物代谢影响很小、。
短期的随机双盲临床试验发现美洛昔康7.5mg/d或15mg/d,与双氯芬酸100mg/d、萘普生750mg/d和匹罗昔康20mg/d等效。大范围国际安全性评估(MELISSA)研究发现,美洛昔康7.5mg/d比双氯芬酸100mg/d所带来的消化道毒性、消化不良、腹痛、恶心、呕吐和腹泻要少得多,尽管二者改善关节痛的程度相同。美洛昔康治疗RA的推荐剂量是15mg/d。
(3)
塞来昔布(celecoxib,商品名
Celebrex):
塞来昔布单剂给药后的
血浆清除率大约500ml/min,在体内的蛋白结合率是97%左右,平均分布于
血浆和红细胞。药物的
血浆清除半衰期是10~12h,足够治疗剂量连服5天后可达到稳定浓度。
塞来昔布的吸收具有生理节奏,晚上给药的吸收要慢于早晨给药。体内和体外实验发现,药物主要由细胞色素P450-2C9代谢,以无活性的形式排出。
塞来昔布与其他药物较少产生临床上明显的相互作用。
在不同的体内条件下,
塞来昔布都显示了对COX-2的高选择性。在一项RA临床试验中,用
塞来昔布分别为200mg和400mg 2次/d,在症状的改善上明显优于安慰剂组,而两种剂量的
塞来昔布治疗组之间效果没有明显差异。治疗组和安慰剂组均没有严重的副反应发生。在
塞来昔布与萘普生和双氯芬酸的比较中,内镜证实
塞来昔布组消化道溃疡的发生率明显低于萘普生和双氯芬酸组。
塞来昔布治疗RA所推荐剂量是成人100mg2次/d或200mg 2次/d。在已知对
塞来昔布过敏,或对
磺胺产生过哮喘或荨麻疹过敏反应,或对阿司匹林或其他NSAIDs有过敏性反应的人,不适宜使用该药。
(4)
罗非昔布(rofecoxib,商品名vioxx):
罗非昔布是一种新型4-甲基苯磺酰衍生物,在体外抑制COX-2的能力是COX-1的1000倍以上。该药口服后,胃肠道吸收很好,绝对生物利用度是93%左右,药物大约85%与
血浆蛋白结合。药物主要被还原成双氢
罗非昔布而不通过细胞色素P450途径。25mg口服后的
血浆清除率是120ml/min,以25mg/d连服4天后可达到稳定浓度。
在对骨关节炎的研究中发现,
罗非昔布12.5mg/d或25mg/d产生的效果与双氯芬酸150mg/d相似,但在双氯芬酸组中因为药物的副作用而停药的比例要明显多于
罗非昔布组。在
罗非昔布的耐受性试验中,
罗非昔布250mg/d、布洛芬2400mg/d、阿司匹林2600mg/d和安慰剂分别连服7天,结果
罗非昔布组的溃疡率与安慰剂组相似,明显低于布洛芬和阿司匹林组。
罗非昔布已经被FDA批准用于骨关节炎的治疗,推荐剂量为12.5mg/d顿服,严重的情况下可以加到25mg/d。应注意
罗非昔布可以引起收缩压的升高,产生临床高血压。那些对阿司匹林或其他传统的NSAID过敏的患者不适合使用
罗非昔布。
(5)开发中的新型COX-2抑制剂:parecoxib是一种注射用的COX-2抑制剂,能缓解手术病人的急性疼痛,减少病人对吗啡的需求。该药肌注或静注均可,并且副作用较小。在对拔第3磨牙(又称智齿)的病人的研究发现,20mg和40mg parecoxib的止痛效果与60mg酮洛酸(酮咯酸)相当,且parecoxib缓解疼痛的时间明显比酮洛酸长。其开发公司Pharmacia已经向美国NDA提出申请。
Pharmacia公司开发的另一种口服COX-2抑制剂valdecoxib目前已经进入后期开发阶段,可用于止痛及类风湿关节炎和骨质疏松的治疗。另外默克公司也正在开发etoricoxib(MK-663)。
5.改变病情药 改变病情药(disease-modifying anti-rheumatic drugs,DMARDs)曾经被作为治疗RA的二线用药,而对RA病人应该尽早进行DMARD治疗已经成为目前风湿病学界的共识。此类药物包括甲氨蝶呤、柳氮磺胺吡啶、抗疟药、硫唑嘌呤、环磷酰胺、环孢素A、
霉酚酸酯、雷公藤,近年开始使用的来氟米特也被包含在此类药物之中。
(1)甲氨蝶呤:
①对甲氨蝶呤治疗类风湿关节炎的认识过程:甲氨蝶呤(MTX)于20世纪40年代首先被Seeger合成,最初用于治疗肿瘤。不过该药在风湿病中的应用迄今也已有50年。尽管甲氨蝶呤用于治疗RA的机制尚未完全明了,但是目前普遍认为它是最有效的DMARDs类药物,其在RA治疗中的价值也越来越受到重视,以至于摆在临床工作者面前的问题不是要不要使用甲氨蝶呤,而是为什么不用甲氨蝶呤。
1972年,Hoffmeister第一个报道了小剂量甲氨蝶呤治疗RA的效果,对78例病人长达15年的治疗追随中,45例病人(58%)取得显著疗效,其中28例病人获得“完全缓解”。自此,甲氨蝶呤治疗RA的临床观察迅速开展。1984和1985年,陆续发表了4个对照研究的结果(表22),结果显示:A.25%治疗组,病人的关节肿、痛明显改善;B.治疗组,病人的晨僵改善平均值为46%;C.治疗组,病人的ESR平均下降15%。
很多学者将甲氨蝶呤和其他二线药物对RA的疗效进行比较,没有发现有哪一种药物优于甲氨蝶呤。无论在对症状的改善或不良反应的发生率方面,甲氨蝶呤都优于硫唑嘌呤。肌注的金制剂和甲氨蝶呤有相同的疗效,但金制剂的毒性要大于甲氨蝶呤。
金诺芬和环孢素A的疗效也不及甲氨蝶呤。甲氨蝶呤和来氟米特的疗效相同,但后者价格较贵。目前普遍认为甲氨蝶呤是DMARDs中单个使用最有效的药物。
一项对26例RA患者长达130个月的观察显示,使用甲氨蝶呤后病情均有显著的改善,6个月后疗效达到最大,12个月和130个月时的疗效没有显著的差别。其中10例患者在130个月疗程结束时,其临床疗效仍然可以维持。50%的患者可以停用皮质醇,33%的患者可以不服用NSAID类药物,并且发现甲氨蝶呤比其他二线药物的耐受性要好得多。美国Scully对124例RA患者用甲氨蝶呤治疗5年后的回顾性分析表明,31%的病人能持续接受甲氨蝶呤治疗而且有临床受益。大多数病人中断治疗的原因是因为药物的副作用,而不是因为其缺乏疗效,虽然大部分病人会出现不良反应,但都较轻,多数只需调整剂量即可缓解。
②甲氨蝶呤的剂量和用法:对于不同的病人,最佳的甲氨蝶呤剂量是不同的,即便同一病人在不同阶段,所需的甲氨蝶呤剂量也有所差别。理想的用药剂量是疗效最大而毒性最小。现在多数风湿病学者均主张甲氨蝶呤单剂量每周给药1次,初始剂量为7.5mg/周,如果不良反应较大,剂量可以减少。如果无明显不良反应,则根据情况逐渐增加2.5~5.0mg/周,直至病情得到控制,或者因毒副反应而不能耐受为止,一般4~12周起效。尽管目前对于RA最佳的甲氨蝶呤剂量还不明确,临床多数应用7.5~20.0mg/周,大多数病人需要10.0~20.0mg/周,部分病人需25.0mg/周,甚至更大剂量才能有较好的疗效。大剂量(30~50mg/周)的使用也被尝试过,但临床报道很少,有待进一步研究。临床症状控制满意后,甲氨蝶呤可以逐渐减量。国外也有将每周用药改为每两周用药维持疗效的报道。甲氨蝶呤的疗效呈剂量相关性,其毒性也同样如此,理论上大剂量应可以取得较好的疗效,但病人往往不易耐受。
甲氨蝶呤给药途径有口服、皮下注射、肌内注射和静脉给药。无论哪一种给药途径,都应该每周单剂量给,以避免毒性。口服给药比较方便,但吸收不如注射途径稳定。如果患者对增加口服剂量后疗效反应仍不理想,可以改为皮下或肌内注射,但此时应注意药物的毒性反应,因为改为注射途径后,可能会增加药物吸收从而增高不良反应的发生率。关节腔内注射甲氨蝶呤并未显示很好的效果。
③补充
叶酸的意义和方法:补充
叶酸可以减轻或预防甲氨蝶呤的黏膜损害、胃肠道反应和全血细胞减少等不良反应。
叶酸的服法每天或每周给药,口服1mg/d即可以减轻甲氨蝶呤的毒性而不影响其疗效。有人试用5.0~27.5mg/周大剂量的
叶酸,发现并不比小剂量显示更多的优越性。亚
叶酸也可以用来减少甲氨蝶呤的毒性。在甲氨蝶呤代谢半衰期内给予亚
叶酸将降低甲氨蝶呤的疗效,所以
叶酸类制剂应在甲氨蝶呤给药24h后服用。但到目前为止,所有补充
叶酸的给法对于防止或缓解甲氨蝶呤的毒性都不能100%有效。已知RA患者可以缺乏多种维生素和矿物质,患者的贫血可能是多种因素引起的,所以应该告知病人须注意饮食平衡或推荐每天补充复合维生素及400μg
叶酸。国外对补充亚
叶酸的剂量和策略进行的多中心大型临床研究提供了可供参考的临床经验。他们的建议是:
a.如果甲氨蝶呤剂量是5.0~12.5mg/周,则在甲氨蝶呤给药后1天给予单剂量亚
叶酸2.5mg/周。
b.如果甲氨蝶呤剂量是15~30mg/周,则在甲氨蝶呤给药后1天给予单剂量亚
叶酸5.0mg/周。
B.对甲氨蝶呤毒性反应的处理:
a.轻度反应时:将甲氨蝶呤减量2.5mg/周,使用上面推荐的亚
叶酸剂量直至反应解除,一旦副作用解除,仍以原方案治疗;
b.中度反应时:停止甲氨蝶呤使用,直至反应缓解。反应缓解后,以低于原甲氨蝶呤剂量5.0mg/周重新开始治疗,如果以前没有补充亚
叶酸则补充之。如果已服用亚
叶酸,则可将其剂量增加2.5mg(甲氨蝶呤<15mg,使用5.0mg亚
叶酸;甲氨蝶呤>15mg,使用5.0mg亚
叶酸,如有必要可加至7.5mg和10mg)。如果2~3周后副作用没有复发,则可按原方案治疗;
c.重度反应时:如果毒性反应很重,以至于威胁生命或需住院治疗,则停用甲氨蝶呤而用亚
叶酸解毒。一旦毒性解除,重新评估病人状况。如果甲氨蝶呤使用是必要的,则按照上面中度毒性的处理办法进行,而且对病人进行密切的监测。
④甲氨蝶呤与其他DMARDs药物的联合治疗:RA治疗的最终目标是阻止骨质的破坏进程,改善已经破坏的骨质。甲氨蝶呤可以减慢骨破坏的进展,但对于缓解骨质的破坏并不是一个理想的药物,因此很多学者主张DMARDs药物联合使用。由于甲氨蝶呤是单独使用最有效的药物,因此应成为联合用药的核心。甲氨蝶呤-环孢素A联合治疗的结果,显示比起两种药单独使用,疗效都要好,尽管合用后血肌酐水平轻微上升,但总体耐受性很好。环孢素A初始剂量是2.5mg/(kg·d),根据临床反应可以每4周增加0.5mg/kg,最终剂量比单用要小。不过使用过程中应注意肾功能的监测,如果肌酐上升超过30%,应减少环孢素的剂量。甲氨蝶呤-柳氮磺吡啶,甲氨蝶呤-硫唑嘌呤,甲氨蝶呤-
羟氯喹-柳氮磺吡啶也均显示疗效优于单独用药,对甲氨蝶呤反应不理想的病人亦可有效。新近发展的生物制剂也被用来和甲氨蝶呤联合使用,如
依他普特(肿瘤坏死因子-α特异性抑制剂)联合甲氨蝶呤,或Infilximab(抗肿瘤坏死因子-α单克隆抗体)联合甲氨蝶呤。研究表明短期的疗效令人满意。来氟米特(leflunomide)是一种新型免疫调节剂,通过抑制嘧啶的合成而发挥治疗作用,短期研究发现与甲氨蝶呤合用后,疗效增强而副作用不增加。理想的联合用药应该是增加疗效同时减少副作用,由于缺乏长期大宗病例的观察研究,各种联合方案的有效性和安全性还需要进一步评估。以下是其他药物和甲氨蝶呤联合使用时可能出现的反应(表23)。
⑤甲氨蝶呤的副作用:甲氨蝶呤的副作用较多,包括胃肠道症状、肝和肺损害、血液学异常、对生殖的影响、脱发、皮肤反应、中枢神经系统毒性及对骨质的影响等。Day等人分析甲氨蝶呤相关不良反应的病例,将药物的副反应归纳为4类:A类为剂量依赖性(如胃肠道毒性);B类为特异性反应(如甲氨蝶呤肺炎);C类为长程治疗相关性,可以根据药物总剂量预测(如肝毒性);D为延迟效应,即便停药后也会发生(如甲氨蝶呤在怀孕前3个月引起的副反应,包括致畸)。
A.胃肠道反应:胃肠道反应是甲氨蝶呤治疗过程中最常见的副作用,也是最容易导致甲氨蝶呤减量甚至停药的原因,包括食欲不振、恶心、呕吐、腹泻、腹痛、消化不良和体重减轻等。大多数病人这些症状都比较轻微,多在给药后短时间内出现,将甲氨蝶呤剂量减少、使用外周途径给药或补充
叶酸都可以减轻症状,并且随着甲氨蝶呤使用时间的延长,病人可以逐渐耐受。
B.肝毒性:在大剂量氨基蝶啶和甲氨蝶呤引入治疗白血病后不久,肝脏纤维化和肝硬化的发生就见诸于报道。20世纪60年代,在使用小剂量甲氨蝶呤长时间治疗银屑病时也发现可以诱发肝硬化。肝组织学检查显示,接受甲氨蝶呤治疗的RA病人的肝脏会发生非特异的病理改变,包括:巨泡性脂肪变性、核变异、肝门区非特异性炎症浸润、局灶性肝细胞坏死、局灶性纤维化和肝硬化。但同时也发现RA和银屑病患者在甲氨蝶呤治疗前就可以出现相似的变化,并且酗酒、肥胖、衰老、糖尿病和一些未知的因素也能造成肝脏损害。由于上述复杂的因素,将肝脏所有的异常改变都归咎于甲氨蝶呤显然也是不合理的。甲氨蝶呤引起肝脏损害的原因还不很清楚,一些学者认为甲氨蝶呤可以激活贮脂细胞,引起
胶原沉积,与酒精共同作用时尤为显著。有些学者报道,长期使用甲氨蝶呤后会引起肝脏和其他组织中甲氨蝶呤和甲氨蝶呤-glu2-7的累积,他们推测对
叶酸代谢的抑制是引起肝细胞损害的原因。
虽然甲氨蝶呤有较多的不良反应,不过,长期接受甲氨蝶呤治疗的RA患者发生严重肝脏疾病的机会是很小的。一项回顾性的研究表明,轻度肝纤维化的发生率是3%~35%,中度至重度肝纤维化发生率是0%~10%,肝硬化发生率是0%~2%。对甲氨蝶呤治疗前后肝活检的比较也得到了相似的结果:甲氨蝶呤使用累积剂量在1200~2600mg时,轻度肝脏纤维化的发生率是0%~52%,严重肝脏纤维化和肝硬化的发生率是0%;5年后严重肝脏疾病的发生率低于1/1万甲氨蝶呤肝毒性的病理分级见表24。
尽管甲氨蝶呤引起的肝毒性发生率低,也有甲氨蝶呤所致的严重肝损害病例的报道。大多数有严重肝损害的患者常常伴有其他危险因素。与肝组织发生异常改变相联系并且独立于甲氨蝶呤的危险因素包括:a.强相关因素:酗酒、既往肝病史、肾功能不全;b.可能相关因素:甲氨蝶呤治疗时间超过2年、甲氨蝶呤累积剂量超过1500mg、以往用过砷剂、肥胖伴有糖尿病;c.潜在的相关因素:甲氨蝶呤每周剂量超过25mg、肥胖、糖尿病、杂合的α1抗
胰蛋白酶缺乏、Felty综合征、曾经接受维生素A治疗、合用NSAIDs药物、与环孢素A合用。
1994年,美国风湿病学会发表了对接受甲氨蝶呤治疗的RA患者肝功能监测的指南(表25)。指南推荐,对有酗酒史、慢性乙肝或丙肝患者、无法解释的持续血清转氨酶升高者应进行肝活检。所有病人均应每4~8周常规进行血清转氨酶、
白蛋白检查。血清肝酶持续升高12个月或RA病情已控制的病人出现
白蛋白低于正常时,应进行肝活检。他们强调,低频率的实验室检查会遗漏,对肝功酶异常的及时发现,任何程度的AST升高都应引起重视。对此指南的评估表明,它的特异性是82%,敏感性是80%,阳性预测值只有27%。
应用美国风湿病学会指南时应注意几个问题:a.恰当的病人选择很重要,对于一些潜在的危险应予以充分的注意;b.AST和ALT任何程度的升高都应注意,肝功酶和
白蛋白的检查间隔不可超过8周;c.低蛋白血症常常说明RA活动性的增加而不是甲氨蝶呤肝毒性所致,肝病引起的低蛋白血症提示肝功能很差。当低蛋白血症的原因不明确时,肝脏超声检查可能有所帮助,大部分情况下,肝脏超声正常可排除严重肝病;d.甲氨蝶呤引起严重肝病时血清AST不一定升高,另外此指南对于甲氨蝶呤每周剂量超过25mg和总量超过10g的病人可能不太适用。所以,对此指南不可过分依赖。
为了减少甲氨蝶呤对肝脏的毒性反应,推荐每周而不是每天使用甲氨蝶呤。理论上,外周给药途径可以避免肝脏的首过效应,比口服给药相对安全。然而这一点并没有足够的证据支持,尤其因为甲氨蝶呤有显著的肠肝循环,胆汁中的浓度较高。很多学者建议在甲氨蝶呤治疗过程中补充
叶酸或亚
叶酸,如Shiroky等报道补充亚
叶酸可以使60%肝酶升高的病人出现酶的降低,提示肝功酶升高可能是
叶酸缺乏所致,亚
叶酸具有保肝效应。减轻甲氨蝶呤对肝脏毒性反应的最佳
叶酸剂量还不很清楚,很多临床工作者使用与甲氨蝶呤每周剂量等量或1/2、1/4量的
叶酸,在甲氨蝶呤服用后12~24h服用。
C.肺损害:RA患者使用甲氨蝶呤时,可以出现肺损害,有时非常显著而且致命,应引起临床工作者的足够重视。甲氨蝶呤相关肺损害有5种临床类型:a.急性间质性肺炎;b.间质纤维化;c.非心源性肺水肿;d.胸膜炎和胸膜渗出;e.肺结节。其中最常见的是急性间质性肺炎。由于RA本身亦可以引起肺间质纤维化,故有时区分肺间质纤维化是否由甲氨蝶呤所致相当困难。对伴有肺疾病的病人使用甲氨蝶呤都应谨慎,一旦在治疗过程中出现肺间质纤维化,只能停药并追随观察。非心源性肺水肿和胸膜炎并不很常见,仅见于大剂量甲氨蝶呤治疗肿瘤时,但亦有在RA中出现的可能性。肺结节的发生也相当少见。曾经有过甲氨蝶呤治疗RA后迅速出现肺结节的报道,临床表现为咳嗽和气短,甲氨蝶呤停药后症状缓解而结节仍存在。
甲氨蝶呤相关肺损害的典型临床经过为亚急性病程,干咳、气短和胸部不适是最主要的症状,还可有发热、疲劳感、呼吸急促和呼吸困难等。咳痰多因合并感染;胸部不适经常是由于胸膜病变或呼吸窘迫所致。从甲氨蝶呤使用到出现肺损害之间的时间不定,从1周到480周均有。开始出现肺损害时,甲氨蝶呤的总剂量在7.5mg~3600mg。没有一个临床症状对诊断甲氨蝶呤相关肺损害是特异的,应对治疗过程中出现的任何新情况保持警惕,如果治疗不及时可威胁生命。影像学检查对评估和诊断甲氨蝶呤相关肺损害非常重要。正常的胸部影像学可排除甲氨蝶呤所致的严重的肺损害。甲氨蝶呤相关肺炎的最典型的影像学表现,是双侧间质和肺泡浸润,尤其在双侧肺底,这种表现被认为是肺泡和间质的病理改变。甲氨蝶呤相关肺损害的特征病理改变有4种,分别是:间质性肺炎、细支气管炎、巨核细胞集聚和间质纤维化。间质炎症的主要细胞类型是淋巴细胞,多形核白细胞偶尔可见,还有巨核细胞形成肉芽肿,嗜酸性粒细胞浸润,2型肺泡上皮增生和发育异常,也可见肺水肿和肺泡渗出,甚至进展到弥漫性肺泡损害(表26)。
甲氨蝶呤相关肺炎的诊断并不容易,需结合临床和实验室检查综合分析。下列诊断标准可供参考:
Kremer标准(1997):主要标准:a.病理证实为超敏性肺炎(无致病性微生物的证据);b.有肺间质和肺泡浸润的影像学证据;c.血和痰培养均为阴性。次要标准:a.气短少于8周;b.干咳;c.室内空气条件下,血氧饱和度<90%;d.DLCO占相应年龄预测值的70%;e.周围血白细胞计数<15×109/L。凡符合主要标准a.,或主要标准b.、c.加次要标准中的3项者为肯定,符合主要标准b.、c.加次要标准的2项者为很可能是甲氨蝶呤所致的肺损害。
此标准已被用来评估和比较具有甲氨蝶呤相关肺炎的病人,调查与此相关的危险因素,但它们的敏感性和特异性还不明确。有的病人具有明确的甲氨蝶呤相关性肺炎,但并不符合诊断标准;亦有的病人肺部病变不是由甲氨蝶呤引起的,却符合诊断标准。还没有研究来调查这3个标准是否等价。所有的标准都是非特异的,最重要的标准应该是开胸或经支气管镜肺活检的特征病理改变,影像学所示的弥漫性间质或肺泡浸润,及肺部细菌学的阴性发现。
对甲氨蝶呤相关肺炎的处理必须个体化,一般来讲包括3方面,即甲氨蝶呤停药、支持治疗和糖皮质激素的运用。有的病人停用甲氨蝶呤后,症状可得到缓解,有的病人效果不大;有的病人需永久停药,有的病人症状好转后仍可继续使用。支持治疗主要是呼吸支持,包括辅助呼吸等。糖皮质激素可以加快甲氨蝶呤相关肺炎的恢复,尽管有的病人不用糖皮质激素,仅仅将甲氨蝶呤停药就可获得完全缓解。糖皮质激素的用法多主张泼尼松至少60mg/d,症状缓解后2~4周内减量。还没有激素减量过程中肺炎复发的报道。病人需要
氧气支持和有明显的肺间质和肺泡浸润是应用激素的强指征。没有证据表明补充
叶酸或亚
叶酸可以缓解甲氨蝶呤相关性肺炎。
甲氨蝶呤相关肺炎的发生率很低,为2.1%~5.5%。多数甲氨蝶呤相关肺炎都可完全治愈,小部分病人遗留永久性肺损害,有的可以并发感染等其他合并症,从而引起死亡。在甲氨蝶呤治疗之前应了解病人的肺部情况。另外,应提醒病人在应用甲氨蝶呤期间对发生的肺部症状要有足够的重视,及时就诊,以期早期诊断,早期处理。
D.血液学异常:血液学的异常包括白细胞减少、血小板减少、巨幼细胞性贫血和全血细胞减少。在甲氨蝶呤治疗的RA患者发生率小于5%。临床上明显的全血细胞减少发生率在1%~2%。发生血液异常的危险因素包括:肾功能不全、透析、
叶酸缺乏、年龄增长、急性病毒感染、饮酒、低蛋白血症和合用丙磺酸、
磺胺等其他药物。平均红细胞体积(MCV)的明显升高可以作为血液学异常的提示,但有的学者认为红细胞体积分布(RDW)的范围变化先于MCV的变化,对于预示血液异常更早,更可靠。当MCV异常增高时,检查红细胞内
叶酸和维生素B
12也是必要的。因甲氨蝶呤诱发血液学改变时应补充亚
叶酸,一般在甲氨蝶呤使用后24~48h补充最有效,剂量与甲氨蝶呤等同。输血、糖皮质激素或造血生长因子的使用对缓解甲氨蝶呤的血液毒性亦有效。
E.中枢神经系统毒性:甲氨蝶呤引起的中枢神经系统的副反应多种多样,包括抑郁、意识模糊、记忆减退、嗜睡、头痛、疲惫等症状。有些症状可以在服药后24h内发生,但多数与服药的时间关系不易确定。大剂量甲氨蝶呤(>1mg/m2体表面积)引起的神经毒性发生率为15%左右,通常是可逆的急性类卒中脑病,表现为癫痫、意识模糊和偏瘫,也有慢性迁延性脑白质病。一项回顾性的研究提示,使用甲氨蝶呤治疗的RA病人中,中枢神经系统毒性的发生率是1%~35%不等。
F.甲氨蝶呤引起的骨病:甲氨蝶呤骨病包括弥漫性骨质减少,首先是骨皮质丢失,下肢胫骨、腓骨和跖骨压力性骨折,典型表现是突发的剧烈疼痛,负重时加重。普通平片有时不能发现,99mTc核素扫描对诊断有帮助。RA患者发生的严重胫骨下端的骨折性疼痛,有时被误认为踝关节滑膜炎的发作。
甲氨蝶呤 10mg肌注后,滑膜、骨皮质和骨小梁内甲氨蝶呤浓度会很高。体外实验表明甲氨蝶呤可以很明显抑制成骨细胞增殖,刺激破骨细胞的聚集,从而增加骨破坏,也可以抑制骨折的愈合。
G.甲氨蝶呤的其他副作用:很多病人服用甲氨蝶呤后常常出现乏力、周身不适、关节痛和肌痛的症状。增大剂量可以加重这些症状。剂量减小、将外周用药改为口服或分次给药可以减轻反应。
大剂量的甲氨蝶呤可以造成肾功能衰竭。小剂量甲氨蝶呤也可引起肾小球滤过率和肾小管功能的下降,停药后可使肾功能恢复正常。当甲氨蝶呤与NSAID类药物合用时,对肾脏的毒性将会加重。小剂量甲氨蝶呤治疗时也可出现脱发,紫外线诱导的红斑反应,荨麻疹和皮肤血管炎。阳萎、少精、男子乳房女性化也见诸于报道,停药后多数可以恢复正常。甲氨蝶呤有明显的致畸胎作用。
甲氨蝶呤引起结节是独特的,发生率约8%。可以在用药几个月或几年后出现,而且经常发生在关节炎症缓解时。典型的征象是多发的小结节,有时为痛性,在手指和不常见的位置如耳郭、脚趾甚至阴茎上出现,位于心脏、肺和脑膜上的结节可引起严重的临床症状。甲氨蝶呤相关结节的发生可能和遗传因素有关,因为与HLA-DRB1
*0401等位基因(OR8.7,95%C.I.2.2-36)
2有相对较强的联系。这种结节的组织学与类风湿结节相似,其形成可能与
腺苷A1受体促进多核巨细胞聚集有关。
甲氨蝶呤影响
半胱氨酸的代谢,25mg/周剂量的甲氨蝶呤可以使血清
半胱氨酸浓度一过性升高,小剂量甲氨蝶呤并不显著改变血清
半胱氨酸浓度水平,但对先天性
半胱氨酸代谢异常的患者必须提高警惕。由于
半胱氨酸是心血管疾病的危险因素,治疗前和治疗过程中的血液检查是必要的。
由于甲氨蝶呤可以产生免疫抑制效应,故长期使用可能会增加感染的发生率。甲氨蝶呤确实可以增加普通细菌感染、带状疱疹和机会性感染(包括隐球菌、巨细胞病毒、奴卡菌和卡氏肺囊虫等)的发生,但一般概率很低。与糖皮质激素合用则机会大大增加。感染的部位大多在呼吸道、泌尿道和皮肤,机会感染的发生率远不如糖皮质激素引起的高。甲氨蝶呤并未被认为是一种致肿瘤的药物,接受甲氨蝶呤治疗的病人也没有增加肿瘤的发生率。一些长期使用甲氨蝶呤的RA患者中,发现患非霍奇金淋巴瘤者相对较多。在这些病例中,当甲氨蝶呤停药后,淋巴瘤大多能消除,由于存在这种关系,甲氨蝶呤被认为与淋巴瘤发生相关。令人疑惑的是,在这些淋巴瘤中很多都可以检测到EB病毒,而EB病毒可能与淋巴瘤的发生具有相关性。所以甲氨蝶呤与淋巴瘤之间的关系还需进一步研究。但对于有EB病毒感染的RA病人使用甲氨蝶呤应谨慎。
关于甲氨蝶呤在围手术期的使用问题争议比较大。有的学者认为甲氨蝶呤可以增加术后感染的机会,影响伤口愈合,增加术后并发症,故主张术前和术后各停用甲氨蝶呤1周。而Grennan等观察388例进行手术的RA病人,发现无论围手术期停用或不停用甲氨蝶呤,或根本不用甲氨蝶呤的病人,他们手术后感染和并发症的发生率并无显著差别。如果手术前停服甲氨蝶呤,则会加重风湿病的活动。
并不是所有的RA病人都适合使用甲氨蝶呤,到底选用哪种DMARD,则因人而异,应综合病人的各方面情况来决定。肾功能不全、既往有肝病或肺病、经常饮酒、妊娠等病人都应避免使用甲氨蝶呤。因为甲氨蝶呤起效时间较快,常常作为病情较活动和关节功能受损病人的推荐用药。用药之前必须对病人的全身情况和病情的活动度作出详细的评价,用药过程中也应定期监测,及时调整用药量。
(2)来氟米特:
①来氟米特的药理特点:来氟米特(Leflunomide,商品名:
爱若华)是异嗯唑的衍生物,具有免疫调节和抗增殖活性,1998年被FDA批准用于类风湿关节炎的治疗。动物模型显示该药物在治疗关节炎、自身免疫性疾病和器官移植方面都有效果。
来氟米特的活性代谢产物A77 1726可以抑制线粒体酶——二氢乳清酸盐脱氢酶(DHODH),而此酶在嘧啶核苷酸尿苷一磷酸(rUMP)的合成中有重要的作用。被抑制的这一步正好是嘧啶经典合成途径的限速步骤。由于激活的淋巴细胞在增殖时需要将嘧啶池扩展大约8倍,为了达到这一要求,淋巴细胞必须动用嘧啶合成的经典和补救途径。抑制DHODH将阻止淋巴细胞聚集足够的嘧啶,从而影响D
NA的合成,最终淋巴细胞的增殖受到抑制。研究表明高剂量的A77 1726可以抑制酪酸激酶活性,而此酶在G0/G1期T细胞和B细胞的信号传导中起作用。来氟米特在治疗剂量下主要还是因为DHODH的活性受到抑制,从而产生一系列的影响。Manna等发现来氟米特可以阻止肿瘤坏死因子诱导的核因子κB(NF-κB)激活Ⅰ-κBα磷酸化,阻止Ⅰ-κBα激酶(IKK)激活,抑制AP-1和c-Jun N末端蛋白激酶的激活,抑制肿瘤坏死因子诱导的凋亡。来氟米特还可以显著抑制中性粒细胞的趋化。在用来氟米特治疗前后对滑膜组织进行活检时发现,治疗后滑膜组织中巨噬细胞、ICAM-1、VCAM-1、IL-1β和基质金属蛋白酶显著减少。
来氟米特口服后很快在胃肠道内被代谢成其活性代谢产物A77 1726和其他次要产物。A77 1726的浓度在给药后6~12h达到峰值,半衰期约14天。药物主要经过肝和肠代谢,肠肝循环显著,最终产物在尿便中各占40%左右。由于来氟米特应用的时间不长,有关药物之间的相互作用还不是了解得很透彻,已知利福平可以增加A77 1726的峰浓度达40%。
②来氟米特的临床应用:来氟米特的临床效果已经被一些临床试验所证实。Smolen等对358例病人给予来氟米特、柳氮磺吡啶和安慰剂的双盲对照试验发现,在4周后治疗组的临床效果显著优于安慰剂组,来氟米特组起效时间较早(4~8周)。在2周时,治疗组关节破坏进程都显著减慢,来氟米特组和柳氮磺吡啶组在临床改善程度和实验室检查方面(除了ESR)没有显著差异,但对于功能残废评估,来氟米特显著优于柳氮磺吡啶。在1年和2年的观察中,来氟米特组的HAQ无论在什么时段都显著优于柳氮磺吡啶组,并且随着时间的延长,其副作用并不增加。Strand等将来氟米特和甲氨蝶呤进行了比较。在12个月的观察中,来氟米特发生作用的时间要稍快于甲氨蝶呤,在关节破坏进程的比较和功能改善程度上,来氟米特组稍优于甲氨蝶呤组,但因为药物的副作用而停药的病人也比甲氨蝶呤组多。Emery等对来氟米特和甲氨蝶呤进一步进行比较也得出了相似的发现。由于A77 1726的半衰期较长,如果不给负荷量则需要2个月或更长的时间才能达到稳定的血药浓度。一般的用法是前3天先给负荷量100mg/d以后10~20mg/d维持。如果给予第一个负荷量后就因为副作用而不能坚持,可以中断几天后再给。有学者建议可以根据病人的不同情况决定以后的剂量,可以每周100mg或隔天20mg。
Kremer指出,来氟米特可以抑制嘧啶的合成,调节淋巴细胞的增殖;而甲氨蝶呤抑制细胞因子的产生和嘌呤的生物合成,并且需要
腺苷的释放。由于来氟米特和甲氨蝶呤作用于不同的环节,二者联合使用将产生协同效应。Weinblatt等考查了来氟米特和甲氨蝶呤联合使用的情况。观察对象为30例在甲氨蝶呤 17±4mg/周剂量下病情仍然活动的RA病人,他们都加用10~20mg/d的来氟米特。52周以后,57%的病人达到ACR20,联合治疗并没有影响两种药的代谢,并且耐受性很好。联合治疗时副作用的发生事件是152起,多为轻到中度,其中最常见的是胃肠道反应(腹泻、恶心、胃炎),其次是肺部症状(咳嗽、呼吸困难、轻微感染)。Kremer回顾了联合治疗试验的结果,共266例活动性RA的病人,随机接受甲氨蝶呤 来氟米特或甲氨蝶呤 安慰剂治疗。24周后甲氨蝶呤 来氟米特组达到ACR20的病人为46.2%,而甲氨蝶呤 安慰剂组则只有19.5%。副作用的发生与先前的观察相似,联合用药组中有2.3%的病人肝酶上升超过基础值3倍,而对照组有0.8%。这些临床试验结果提示,来氟米特与甲氨蝶呤在活动性RA病人身上联合使用优于甲氨蝶呤单独使用,并且耐受性良好。
来氟米特的副作用通常都比较轻,而且发生率也不高。副作用主要是胃肠道反应,其中腹泻有22%~26%,恶心9%~13%;皮疹占约12%;可逆性脱发占大约8%;高血压占6%左右;肝酶升高(AST和ALT)占6%~10%。大部分副作用都在用药的最初几周内发生,并且很多不需要停药就可以好转。尚未报道血液系统方面副作用和感染概率的增加。来氟米特剂量超过20mg/d时副作用的发生会增加。
来氟米特的使用时间并不很长,其价格也比较昂贵,目前尚不能取代甲氨蝶呤。多数学者建议对甲氨蝶呤单用反应不佳的病人可以加用来氟米特,或在不能耐受或不能使用甲氨蝶呤时用其代替甲氨蝶呤。由于来氟米特,引起肝酶升高的作用比较突出,FDA建议使用前和开始使用后每月检查肝酶水平,稳定后可以每2~3个月检查1次肝酶。如果用药过程中肝酶水平持续超过2倍正常上限,则需要将药物减量;如果肝酶水平超过3倍正常上限则需要停药。考来烯胺可以用来加快来氟米特的清除,口服8g考来烯胺,3次/d,24h后可以将药物
血浆浓度减少40%,48h后减少50%~65%。来氟米特具有致畸作用,不能用于孕妇。由于药物的正常清除有时需要长达2年左右的时间,因此使用该药物的女性如果想怀孕必须停药,并且使用考来烯胺促使药物的清除。美国风湿病学学会在《类风湿关节炎治疗指南2002版》中指出梗阻性胆道疾病、肝病、病毒性肝炎、严重的免疫抑制状态、不充分的怀孕准备和使用利福平治疗为来氟米特治疗的禁忌证。
(3)柳氮磺吡啶:
①柳氮磺吡啶的药理特点:20世纪30年代末期Svartz首次将
美沙拉秦(
5-氨基水杨酸)和
磺胺吡啶通过偶氮键连接,合成了柳氮磺吡啶并于1942年报道了用于风湿性多关节炎和溃疡性结肠炎的正性治疗反应。1949年Sinclair和Duthie发表了比较柳氮磺吡啶、金制剂和安慰剂作用的非对照临床试验结果,该结果显示这3种制剂的效果无显著性差异。在此后的30年内该结果被广泛接受,并且对柳氮磺吡啶在风湿性疾病疗效的研究也几乎终止了。直到1980年McConkey报道了74例类风湿关节炎的病人采用柳氮磺吡啶治疗取得了令人鼓舞的结果:4周后临床症状明显改善、C反应蛋白和血沉明显下降,且症状持续缓解8个多月。此后,很多对照性临床试验都证实了柳氮磺吡啶在RA中的治疗作用。
柳氮磺吡啶的吸收只有10%~20%,被吸收的药物95%以上与
血浆蛋白结合,服药后4~6h
血浆达峰值,半衰期一般是6~17h。大部分的药物在服用后到达结肠,在此处被细菌分解成
磺胺吡啶和
美沙拉秦,前者可能是在风湿病中起活性作用,后者是治疗溃疡性结肠炎的活性成分。柳氮磺吡啶的代谢受人体乙酰化和氧化能力的影响,乙酰化作用快的个体疗效较差,然而并没有发现
磺胺吡啶血浆浓度和临床效果之间的关系。柳氮磺吡啶药代动力学、临床效果和副作用的发生率不受年龄的影响。
尽管柳氮磺吡啶用于RA的治疗已经将近50年,它的作用机制还没有完全清楚。柳氮磺吡啶可以影响很多炎性介质。柳氮磺吡啶,更大程度上是
美沙拉秦在起作用,可以清除由多形核细胞释放的活性物质及其产物。该药物还抑制不同的前列腺类物质的产生,包括IL-B4、5羟基二十碳四烯酸和血栓素A2。柳氮磺吡啶治疗可以减少循环的激活淋巴细胞,抑制B细胞活性,显著降低IgM和类风湿因子滴度,减少淋巴细胞对刺激的反应,10%以上的病人还可以出现低丙种球蛋白血症。柳氮磺吡啶治疗16周后可以改变肠黏膜淋巴细胞亚群的分布。柳氮磺吡啶还能显著降低IL-1α、IL-1β和肿瘤坏死因子-α浓度,减少IL-6的产生。Carlin及其同事证实柳氮磺吡啶和
磺胺吡啶都可以抑制第二信使的流出,如胞液钙、甘油二酯和三磷酸
肌醇。这些作用可能依赖于药物在
磷脂酶C或其调节性鸟苷三磷酸结合蛋白水平的作用,以此可能解释药物对炎症介质和淋巴细胞功能的作用。柳氮磺吡啶还可以促使细胞中抗炎分子
腺苷的积累,故有类似于甲氨蝶呤的药效作用。
②柳氮磺吡啶的临床应用:柳氮磺吡啶治疗RA时可以减轻全身及关节局部的炎症,改善晨僵,并可以降低血沉和C反应蛋白。两个短期随机、双盲、安慰剂对照临床试验证实了柳氮磺吡啶 3g/d的临床疗效,但是两者都显示了较高的治疗中断率(Pinals的研究有28%),主要由于上消化道的副作用。在对病程少于12个月的RA患者使用柳氮磺吡啶的研究中,治疗组可以产生骨关节侵蚀减少的趋势。在一个48周对早期RA使用柳氮磺吡啶和
羟氯喹的比较的研究中,柳氮磺吡啶产生作用更快,并且在24周、48周和3年的随访过程中柳氮磺吡啶组显示了更轻的关节侵蚀进程。
在大部分研究中,柳氮磺吡啶用药后4周即可起效,明显快于抗疟药,一般4个月内有显效,如果此时还不能产生效果,应考虑调整治疗。McConkey报道柳氮磺吡啶治疗RA的有效剂量至少1.5g/d,成人最普遍的剂量是2g/d肠溶片,分两次餐中服用。为减少对药物的不耐受,可以从0.5g/d开始,每周增加0.5g,直到治疗剂量为止。研究表明,2g/d和3g/d的剂量在临床疗效上没有显著差别,因此剂量增加不一定能增加疗效。柳氮磺吡啶的疗效与金制剂和青霉胺相当,但毒性要小,它的疗效优于抗疟药、
金诺芬和硫唑嘌呤而不及甲氨蝶呤,但也有的研究认为柳氮磺吡啶与甲氨蝶呤的疗效相当。在欧洲柳氮磺吡啶的使用较多,尤其在英国,几乎成为首选用药。
近年人们的注意力转向柳氮磺吡啶和其他药物的联合使用。柳氮磺吡啶和甲氨蝶呤的联合使用显示了临床效果中等程度的增加,但是与单独用药组没有统计学差异,副作用并不高于甲氨蝶呤单用。对102例RA病人的为期2年双盲研究发现,甲氨蝶呤、柳氮磺吡啶和
羟氯喹三者联合使用的疗效明显优于这3种药物单独使用。以后对早期RA联合使用上述方案也发现可以产生显著的临床效果,显示早期诱导炎症的缓解可以延缓关节破坏的进展。
柳氮磺吡啶的副作用见表27,一般可以分为两类:一类是剂量相关性,属于可以预期的,如头痛、恶心、呕吐、乏力、溶血性贫血;另一类为变态反应性,与剂量无关,是不可预期的,如皮疹、再生障碍性贫血、自身免疫性溶血等。常见的副作用多数在开始治疗后2~3个月出现,减少剂量有助于减轻不良反应的发生。柳氮磺吡啶治疗过程中的监测见表28。
(4)抗疟药:
①抗疟药的药理特点:抗疟药(antimalarials)首次用于类风湿关节炎的治疗是1951年,目前临床上常用的是
氯喹(chloroquine,CQ)和
羟氯喹(hydroxy-chloroquine,HCQ),
羟氯喹较易进入细胞核和溶酶体,所以效果较好,国内这两种药都有生产。
抗疟药的药理作用比较复杂,至今尚不十分清楚。有研究认为,抗疟药可能通过改变细胞内的微环境而影响细胞的功能,从而带来对炎症、免疫反应和酶活性的一系列影响。这些作用的始动步骤(又称趋溶酶体作用)得以发生是因为抗疟药是弱碱性,可以进入溶酶体,使pH值升高,干扰依赖于酸性环境的酶活性。
氯喹还可以抑制蛋白的分泌和胞内加工过程。抗疟药影响免疫反应的多个方面。Fox和Kang认为胞内pH值的改变会影响自身抗原加工及自身抗原多肽与Ⅱ型主要组织相容抗原的结合。
氯喹可以抑制淋巴细胞对刺激的增殖反应,在体内和体外都可以抑制NK细胞。抑制淋巴细胞的转化和浆细胞的活性,其结果是γ球蛋白和类风湿因子的生成减少,淋巴细胞和成纤维细胞增殖受到抑制。在体外,
氯喹可以减少细胞因子信使
RNA的表达,从而减少IL-1、IL-6、肿瘤坏死因子-α和IFN-γ的生成,并减少它们在
血浆的释放。
氯喹还可以通过减少IL-2生成和T细胞对IL-2反应来抑制T细胞的增殖。抗疟药还可以减少很多酶的活性,包括
磷脂酶A2、单胺氧化酶和胆碱酯酶。除了对酶直接的抑制作用外,抗疟药还可以稳定溶酶体膜,减少溶酶体内酶的释放。抗疟药还能抑制吞噬细胞的趋化和吞噬功能。
氯喹口服吸收迅速而且完全,一般服后2~3h血中浓度达到高峰,生物利用度为75%。分布容积大,广泛分布于全身,在脾、肾、肺、心、肝等组织中药物浓度为
血浆中的300~500倍。
氯喹的
血浆半衰期为3.5~12天,血药浓度主要取决于其分布而不是排泄,故肾衰时无需调整剂量。
氯喹主要在肝脏代谢,原药及其代谢产物主要经肾排泄。本品对含有黑色素的皮肤和眼等软组织有很高的亲和力。
②抗疟药的临床应用:抗疟药从来没有被认为能减慢关节的侵蚀,被称为DMARD只是沿用历史的叫法。早期使用
氯喹和
羟氯喹治疗RA的对照试验表明,关节炎症可以得到抑制。后来的多中心对照研究亦显示,在早期RA中抗疟药可以减少关节炎症和晨僵,并且严重副作用的发生率很低。在开放性的研究中,60%~70%的病人可有明显的临床效果。1991年Davis报道,血沉低于30mm/1h、C反应蛋白低于20mg/L且病情较轻的病人,每天口服400mg
羟氯喹有较好的疗效,提示抗疟药对于早期和轻度的RA有良好的治疗作用,此点也为美国风湿病学学会《类风湿关节炎治疗指南2002》所肯定。
羟氯喹对RA症状改善的效果与柳氮磺吡啶及环孢素A相当,而且不比HCQ与柳氮磺吡啶联合使用时的效果差。尽管
羟氯喹单独使用并不能减慢骨关节破坏的进程,但是用于早期RA可以显著改善病人的长期预后。近年有人将HCQ、甲氨蝶呤和柳氮磺吡啶三者联合使用治疗早期RA,发现疗效显著优于这3种药单用,并且可以更好地减轻骨关节破坏。
抗疟药的起效时间比较慢,一般在3~6个月,由于这个特性,目前有将它与一种作用较快的药物(如甲氨蝶呤)合用的倾向。常用剂量为:
氯喹4mg/(kg·d),
羟氯喹6mg/(kg·d)。最近一项对病情较轻的RA病人使用不同剂量(400、800、1200mg/d)的
羟氯喹治疗的研究发现,剂量最大组的疗效最好。Weinblatt认为
氯喹和
羟氯喹均有蓄积毒性,建议最大剂量为
氯喹3~4mg/(kg·d),
羟氯喹6~7.5mg/(kg·d)。近几年的临床观察发现,
羟氯喹每天剂量不超过400mg时的安全性很好。
抗疟药的副作用比较少,其发生与剂量有关。较常见的有胃肠道反应如恶心、呕吐等,腹部绞痛和腹泻常有发生。皮疹也属于常见的副作用,但其发生因人而异。神经系统方面的副作用有头痛、眼花、失眠和紧张,严重的反应很少,随着剂量的减少大多可逆。神经肌肉病变的发生一般较少,可有下肢近端肌肉无力(一般在开始治疗数月后),神经和肌肉活检可出现异常。抗疟药对眼部的影响有3方面:眼球调节障碍、角膜药物蓄积和视网膜病变。前两种病变可以逆转,第3种病变可以带来永久的失明,但所幸的是,在常规治疗剂量下发生率非常低。从1960~1989年总共只报道了18例病人发生了视网膜病变,其中有16例
羟氯喹的剂量超过了7mg/(kg·d)。目前认为
羟氯喹6~7mg/(kg·d)的剂量一般不会产生视网膜病变。一旦出现视网膜炎早期症状,应停药并加用促进
氯喹排泄的药物如
氯化铵、大量维生素C、硫酸软骨素和2-巯基丙醇等。另外,抗疟药还可以引起心衰和房室传导阻滞。
抗疟药的副作用发生率很低,被认为是比较安全的DMARD,而且价格也不昂贵。使用时也不需要进行定期的常规实验室检查如血细胞计数、肝肾功能等,但是需要定期进行眼科检查以及时发现可能的病变。怀孕的妇女不建议使用,因为药物可能会影响孩子的听力。有的学者建议在抗疟药治疗期间可采用如表29的方法。
(5)硫唑嘌呤:
①硫唑嘌呤的药理特点:硫唑嘌呤(azathioprine,AZA)是一种嘌呤的类似物,在体内迅速被转化成巯嘌呤(6-巯基嘌呤),进一步受次黄嘌呤核苷焦磷酸酶(HG-PRT)催化生成硫代肌酐酸,后者竞争性抑制肌酐酸的合成。因为肌酐酸是
腺苷酸和鸟苷酸的前体,抑制肌酐酸的合成将导致抑制D
NA的合成。硫唑嘌呤是细胞周期特异性药物,抑制S期细胞,因此它主要杀伤迅速分裂、增殖的细胞。硫唑嘌呤可以抑制细胞介导的免疫反应和体液免疫反应,对于初次的或再次的免疫应答均有抑制作用。硫唑嘌呤对T细胞的抑制作用比B细胞强,并可抑制NK细胞活性。硫唑嘌呤具有抗炎作用,可以缓解RA的关节肿胀和疼痛。
②硫唑嘌呤的临床应用:硫唑嘌呤一般从50mg/d或1~1.5mg/(kg·d)开始,如果耐受良好可以在1~2周内增加到2~2.5mg/kg,每1~2周增加25mg可以使病人具有更好的耐受。由于硫唑嘌呤对血管刺激性较强,目前一般不静脉给药。硫唑嘌呤开始用药后发生作用比较缓慢,一般3~6个月起效。一些前瞻性的临床试验证明其效果不及甲氨蝶呤,硫唑嘌呤联合甲氨蝶呤治疗RA的效果也不比甲氨蝶呤单用优越。硫唑嘌呤目前已经较少用于RA的治疗,除非病人对其他药物不耐受或反应不好,或有RA全身表现或合并其他结缔组织病的RA患者。硫唑嘌呤在临床上最普遍的应用是作为减少糖皮质激素用量的药物来治疗SLE和其他自身免疫疾病。
硫唑嘌呤常见的副作用有胃肠道不适,包括恶心和呕吐,饭后或睡前服药可以减少胃肠道反应,15%~30%的病人会由于此副作用而在6个月内停用。肝酶轻微升高可见于5%~10%的病人,严重的肝毒性、胆汁淤积很少见。可逆性的骨髓抑制也较常见,与剂量有关,治疗期间应该定期检查血象。严重的骨髓抑制发生率较低,被认为是对硫唑嘌呤的特发性反应,这种病人中的大部分硫唑嘌呤甲基转移酶活性都较低或缺乏,如果能提早检测该酶的含量,则可以避免使用后发生严重骨髓抑制的事件。有人报道硫唑嘌呤治疗器官移植时可以增加淋巴增殖性肿瘤的发生率,但是此类报道尚未见于RA的治疗。
(6)环磷酰胺:
①环磷酰胺的药理特点:环磷酰胺是氮芥的类似物,本身为无活性的物质,经肝细胞内P450氧化后,生成具有活性的代谢产物,从而使D
NA双链交叉联结,阻碍D
NA复制,使有丝分裂不能正常进行。环磷酰胺为周期非特异性药物,对增殖细胞和非增殖细胞都有杀伤作用,但是各种细胞的敏感度不同。环磷酰胺可以使T细胞和B细胞的绝对数目减少,减少淋巴细胞增殖,减少抗体生成,并且能抑制正在进行中的免疫应答过程。环磷酰胺对B淋巴细胞(包括静息和被激活的细胞)的抑制作用被认为在该药的临床作用中发生着重要的影响。
环磷酰胺口服吸收良好,很快被代谢成活性产物。环磷酰胺清除半衰期是2~8h,大部分病人施以12mg/kg 24h后,
血浆中已经测不出烷基化活性。环磷酰胺大部分都以无活性的形式由肾脏排泄,然而也有10%~20%以原形排出,并含有部分活性产物。
②环磷酰胺的临床应用:1951年氮芥作为第一个烷化剂被用于难治性RA的治疗,此后环磷酰胺逐渐成为治疗RA的主要烷化剂。环磷酰胺可以改善RA的症状,也可以在一定程度上防止骨侵蚀。口服剂量为1~2mg/kg,或100mg/d,或隔天服药200mg。静脉给药为每周2次,每次200mg。尽管环磷酰胺对RA有一定的疗效,但由于长期使用的副作用较大,其临床应用受到限制。目前FDA并没有批准环磷酰胺用于RA的治疗,有学者认为当出现了类风湿血管炎时可以静脉使用环磷酰胺,但环磷酰胺对关节炎帮助不大。所以在给病人使用环磷酰胺之前要考虑临床受益和风险。
环磷酰胺常见的副作用为骨髓抑制、出血性膀胱炎、精子减少、卵巢功能衰竭及脱发。胃肠道反应如恶心、呕吐一般较轻,以注射给药比较常见,一般持续12h左右即可消失。脱发的发生率比使用其他烷化剂要高,多发生于用药3~4周后。由于环磷酰胺的活性代谢产物由尿液排出,对膀胱有刺激作用,故可以引起出血性膀胱炎。环磷酰胺偶可诱发膀胱癌,一般多在环磷酰胺总量超过12g时发生,与给药途径无关。
治疗期间应定期检查血、尿常规,甚至进行尿液细胞学检查,并嘱病人多喝水,增加尿量,从而减少环磷酰胺代谢产物在膀胱内停留的时间。有学者建议同时使用美司纳以减少膀胱毒性。
(7)环孢素A:
①环孢素A的药理特点:环孢霉素(cyclosporine)是一种亲脂性的环状多肽,主要运用于器官移植,近来在从类风湿关节炎到自身免疫性眼病等的自身免疫性疾病中也有所应用,而应用较多的是环孢素A(CsA或CyA)。
环孢霉素可以与亲环蛋白(cyclophilin)结合形成复合物,该复合物可以结合并抑制钙调磷酸酶(calcineurin),后者是一种丝氨酸-苏氨酸磷酸化酶。该磷酸化酶的抑制可以防止激活T细胞中胞液核因子向细胞核的移位,而该移位是细胞因子(如IL-2)基因转录和T细胞激活所必需的。所以环孢霉素可以抑制CD4 T淋巴细胞活性和其他Th1细胞因子的产生,抑制CD40配体((CD40L)在T淋巴细胞的表达。后一种作用会防止T细胞通过依赖于CD40L途径向B细胞传递信号。
环孢素A肠道吸收较差并且变化很大,高脂饮食可以增加其吸收,生物利用度大约30%。达峰时间为1~8h,清除半衰期为3~20h。药物吸收后广泛分布于体内,在周围组织中的浓度大于
血浆浓度。药物在血中与
血浆蛋白、红细胞和脂蛋白结合。环孢素A在体内的代谢和排泄主要受两种因素的影响。一是P-糖蛋白(P-GP),这是一种药物流出泵,可以将药物如环孢素A等泵出细胞外,该泵在肠上皮细胞和肝中表达。另一种是CYP3A4酶系统,环孢素A主要被该酶代谢,这种酶系统同样在小肠上皮和肝中具有活性。因此P-GP限制药物的摄入,CYP3A4促使药物的代谢,这两种因素限制环孢素A的生物利用度,对这两种因素有影响的药物都可以影响环孢素A的血药浓度(表30)。
环孢素A在体内可以被代谢成至少20种代谢物。口服环孢素A有两种不同的形式:老的油溶性配方(商品名Sandimmune)和新的微乳剂配方(商品名Ueoral)。新剂型的达峰时间比老剂型缩短25%,药物的最高浓度和浓度曲线下面积增加约50%。新剂型目前已经逐渐取代了老剂型。
②环孢素A的临床应用:1979年Herrman和Mueller首次观察了环孢素A在RA中的应用,开始的剂量很大(大于10mg/kg),带来了严重的副作用。第一个使用小剂量环孢素A治疗RA的随机双盲安慰剂对照试验由Dougados等进行。该试验包含52例病人,环孢素A的平均剂量是5mg/(kg·d),一共观察了4个月。治疗组54%产生良好的治疗效果,安慰剂组为8%,治疗组中13例血肌酐上升超过50%,药物减量后在1周内有12例恢复正常。以后很多临床试验都证明了环孢素A无论作为单药使用还是联合其他药物都可以缓解RA的症状,减慢关节破坏的进程,并且大剂量使用的效果要好于小剂量,但是毒性也同时增加。很多临床试验使用不同的药物剂量试图找到一个最佳剂量以使效果最好而毒性最小。Dijkmans认为2.5~3.8mg/(kg·d)的剂量是平衡疗效和毒性的最佳范围。Jaffe则认为4mg/(kg·d)是最合理的剂量。目前环孢素A推荐的开始剂量是2.5~3.5mg/(kg·d),分两次服用,最大不超过5mg/(kg·d)。环孢素A起效也相对较慢,一般4~8周起效,在12周以后可达到最大疗效。使用时可以从2.5mg/(kg·d)开始,每4~8周增加0.5mg/(kg·d)至最大剂量,效果稳定后可以每4~8周减少0.5mg/(kg·d),直到以最小的剂量维持。用药4~6个月如果还没有临床效果则应该停药。新老剂型的换算是1∶1,但由于新剂型的吸收增加,应监测可能出现的毒副作用。
Landewe进行的临床试验表明,环孢素A和
氯喹分别治疗24周时疗效相当,而1年后环孢素A治疗组的效果明显比
氯喹组要好。由于环孢素A抑制IL-2产生和抑制T细胞活性,而甲氨蝶呤抑制IL-1、单核细胞和巨噬细胞,所以它们具有协同作用,将这两种药联合使用也是合理的。研究表明,将环孢素A和甲氨蝶呤联合使用优于甲氨蝶呤单独使用,并且在对甲氨蝶呤反应不好的患者中也可以起到一定的疗效。联合用药时环孢素A的剂量也小于单独用药时的剂量。目前的临床试验结果都提示联合环孢素A的治疗可以在难治性RA中取得一定的效果,长期的临床观察正在进行。
环孢素A的副作用最突出的是肾毒性,几乎所有接受此药治疗的病人都会出现血肌酐的上升,大部分为可逆性,在环孢素A减量或停药后可恢复至正常。大部分的临床观察都发现,在开始治疗的2~3个月内就会出现肌酐的轻微上升,以后可以保持12个月的稳定水平。也有研究表明,尽管治疗的第1年肌酐水平可以保持稳定,一部分患者以后肌酐的水平可以上升超过基础值的30%,并且即使将药物减量后也不能改善,而不得不停药。一旦出现不可逆的环孢素A诱导性肾病则是一个严重的问题。引起肾损坏的机制尚不十分清楚,可能包括导致血管收缩的血栓素和内皮素的增加,舒张血管的前列腺素的减少以及血管敏感性的改变。慢性环孢素A诱导性肾病的特征性组织学改变是局灶性间质纤维化、小管萎缩和小动脉的异常。Forre认为环孢素A剂量大于7.5mg/(kg·d)时,对高龄患者、有肾脏病史或合用其他对肾脏有毒性的药物时,都可以使肾毒的危险性增高,因此环孢素A的剂量应不超过5mg/(kg·d),当血清肌酐水平升高50%以上时应该调整药物剂量。
环孢素A的其他副作用还有高血压,发生率大约是20%,减量或使用降压药一般都可以控制。胃肠道反应也比较普遍,但一般都较轻,并且是暂时性的,亦有病人为此而停药。不常发生的有多毛、齿龈增生、震颤、皮肤感觉异常、乳房压痛、高钾血症、低镁血症和血尿酸增高等。
由于环孢素A的副作用较大,对于它在早期RA的运用还存在争议。环孢素A联合甲氨蝶呤的治疗已经显示了良好的效果,而且在1年内的安全性都可以接受,所以它可以作为其他DMARD反应不佳或不耐受时的替代,并且作为治疗甲氨蝶呤反应不佳RA的联合治疗药物之一。使用该药物时要小心,可以参考表31的指南。
(8)雷公藤:雷公藤为卫矛科植物的全株,别名黄藤木、断肠草和红药等,性寒、味苦,有大毒,其皮有毒。雷公藤治疗类风湿关节炎已有近30年的历史。早在20世纪70年代杨氏采用雷公藤合剂治疗RA 80例,总有效率95%。郭氏采用雷公藤酊剂,也取得满意疗效。多数人服药3~5天后,疼痛即可减轻,甚至消失,可以显著消肿和改善功能。雷公藤的其他制剂如多苷、
醋酸乙酯提取物、浸膏片、冲剂和糖浆剂等治疗RA均有一定的效果。北京协和医院经过随机双盲对照试验发现,雷公藤总苷(雷公藤多苷)60mg/d治疗3个月,其临床和实验室指标比对照组有明显的进步。雷公藤治疗RA的机制目前仍然在探索中,陶氏发现在体外雷公藤可以抑制单核细胞产生IgM(包括IgM RF)。临床观察表明,雷公藤对体液和细胞免疫都有作用。
由于雷公藤的制剂众多,剂量和用法也不统一。陶氏经过临床观察发现,使用雷公藤总苷每天60mg和30mg在大部分临床和实验室指标的改进上无差别,并且每天服用30mg治疗时严重副作用的比例显著减少。有学者认为雷公藤,可以明显改善病人的关节症状,并认为主要作用于急性活动期,可以帮助减少或撤除糖皮质激素的使用。目前认为雷公藤起效快,平均7天(1~15天)起效,近期疗效肯定。
雷公藤的常见副作用有腹泻、皮疹、口炎、色素沉着、脱发、皮肤黏膜损害、白细胞和血小板降低、对生殖系统的影响等。除生殖系统外,其他副作用一般都是可逆性损害,减量或停药并对症治疗后都可恢复。雷公藤对生殖系统的影响需要特别注意。育龄期妇女服药一般2~3个月后出现月经紊乱,服用半年后约52%的患者出现闭经。停药后月经恢复至正常者约占70%。凡年过40岁者,即使短期服药亦可导致闭经,停药后不再来潮。年轻妇女服药时间较长也可完全闭经,服药时间3年以上即使停药也难恢复,且可伴有性欲减退和阴道分泌物减少。陈氏曾报道1例32岁女性,服用雷公藤6年,死后尸检发现子宫明显小于正常,卵巢趋向萎缩,卵巢内卵泡少于正常。故对儿童、未婚女性和希望生育的育龄期妇女要慎用本药。在男性,小剂量雷公藤就可使精子生成减少,引起不育。因此男性患者亦要慎用此药。
关于雷公藤对RA的治疗效果,各家报道不一,由于判断的标准也不完全一样,因此结果难以进行比较。雷公藤能否改变骨关节侵蚀的进程尚无报道,其远期疗效也需要进一步观察。目前认为雷公藤,确实具有一定的抗炎和免疫抑制作用,用于治疗RA的近期疗效也比较肯定,但是还有相当多的问题尚需解决,故还要进行大宗病例的随机双盲对照性临床试验,以进一步观察远期疗效和可能带来的问题。国内学者研究发现,雷公藤治疗RA的有效剂量和毒副反应剂量很相近,很难将止痛消炎作用与对生殖系统的副作用分开,因此在选择病人的时候需要极其慎重。
6.糖皮质激素 到目前为止,还没有发现其他任何药物可以像糖皮质激素(glucocorticoid)一样迅速而有效地控制滑膜炎和缓解类风湿关节炎的症状。尽管糖皮质激素在RA中使用的经验已经积累了50年左右,目前对它还存在一些争议。研究糖皮质激素在RA中应用的历史说明,对一种慢性疾病的治疗结果进行分析是很复杂的。
(1)全身应用:
①糖皮质激素的药理特点:糖皮质激素通过多种渠道发挥强大的抗炎作用。研究表明,糖皮质激素对免疫调节蛋白和免疫调节细胞均有作用,包括减少炎性渗出、降低炎性介质的产生和作用、减少炎性细胞的聚集、减少炎性细胞的激活等。通常情况下,糖皮质激素对细胞免疫的抑制强于对体液免疫的抑制。现将糖皮质激素抗炎的可能机制概括如下(表32,33)。
②小剂量糖皮质激素在RA治疗中的应用:在20世纪50年代,英国医学研究顾问委员会(Medical Research Council)和Naffield基金会开展了一些临床试验观察糖皮质激素在RA中的疗效。最初的试验使用阿司匹林和相当于每天16mg泼尼松(prednisone)的糖皮质激素进行比较,观察发现两组在疗效上无明显差异。第2个试验同样发现阿司匹林与糖皮质激素在治疗RA时临床效果没有明显差异,尽管糖皮质激素治疗有防止骨关节侵蚀的趋势,但是这一点在两组无统计学差异。此后,风湿病学界接,受了这两个临床观察的结果,认为糖皮质激素虽然具有很好的抗炎作用,但是不能缓解骨关节破坏的进程。第3个临床观察仍然是将糖皮质激素与阿司匹林进行比较,经过3年随访发现糖皮质激素在临床症状改善上明显优于阿司匹林,并且糖皮质激素治疗的RA病人其关节病变进展的速度要显著慢于阿司匹林组。考虑到糖皮质激素长期使用所带来的副作用,风湿病学家们仍然对它持有保留态度。Weiss于1989年重新评估了以前临床观察的数据,随后小剂量使用糖皮质激素的观点渐渐引起了人们的注意。1995年,Kirwan等和关节与风湿病顾问委员会小剂量糖皮质激素研究组(Arthritis and
Rheumatism Council Low Dose Glucotorticoid Study Group)开展了一个大型临床试验,观察小剂量糖皮质激素对骨关节病变的影响。研究中所有的病人都使用其他DMARDs药物,他们被随机分成两组,一组加用7.5mg/d泼尼松龙,另一组加用安慰剂。经过2年的随访,在研究结束时发现合用糖皮质激素在防止骨关节破坏的进展方面要显著优于安慰剂组。Boers、Wassenberg等人各自进行的临床观察也发现糖皮质激素对骨关节破坏具有显著的保护作用。
糖皮质激素的副作用已经被人们充分了解,它们的发生大多数都与使用的剂量和时间有关。糖皮质激素产生的副作用包括下面几个方面:免疫(减少免疫应答、增加对感染的易感性)、内分泌和代谢(下丘脑-垂体-肾上腺轴受到抑制、糖耐量下降、高脂血症、低钾和碱中毒、性腺功能下降、伤口愈合能力下降、体重增加、负氮平衡、消耗肌肉)、心血管(液体潴留、高血压、动脉粥样硬化)、胃肠道(胰腺炎、溃疡病)、肌肉骨骼(骨质疏松、缺血性坏死、肌病)、皮肤(紫纹、多毛、皮肤脆性增加、瘀斑、痤疮)、眼(白内障、青光眼)、神经精神(情绪改变、失眠、抑郁、精神病、假脑瘤)等。当泼尼松剂量为7.5mg/d或更少时,以上大部分的副作用很少发生,但是有些副作用如体重增加、轻微皮肤症状、白内障形成、糖耐量下降和骨量丢失可以很快发生。
尽管有的研究结果显示小剂量糖皮质激素有利于减慢RA骨关节破坏的进展,但是由于糖皮质激素的副作用,此种用法尚未被多数学者接受。由于在观察小剂量糖皮质激素的临床试验中,随访时间最多不超过4年,对于更长时间小剂量糖皮质激素所带来的风险/效益比(risk effective ratio)如何,尚无明确答案。另外,在保护骨关节方面,小剂量糖皮质激素所带来的风险/效益比与DMARDs所带来的风险/效益比二者孰优孰劣,也没有肯定的答复。因此,还需要进行时间更长的临床观察,以进一步研究糖皮质激素尤其是小剂量使用在RA治疗中的地位。目前比较认同的可以在RA中使用糖皮质激素的情况有:A.对威胁生命的关节外受累(例如,类风湿血管炎、类风湿肺炎等)的治疗,一般使用中等或大剂量;B.在下台阶方案中作为“桥梁”(bridging)作用控制滑膜炎,以等待DMARDs起效;C.根据RA急性发作的情况,不定期加用小剂量激素以控制滑膜炎。
小剂量糖皮质激素(泼尼松<10mg/d)对缓解具有活动性RA病人的症状就已经非常有效,一般在给药后的几天内关节炎的症状就可以很快缓解,但大部分病人在停药后症状很快就可以复发。有少部分病人即使在使用足够的DMARDs后,仍然需要糖皮质激素以控制关节炎症状,从而需要长期依赖于糖皮质激素。对这部分病人,糖皮质激素用量应控制在最小,最好能够使用泼尼松≤10mg/d。对缓解RA急性发作时的症状而言,一般的用法是起初给泼尼松7.5mg/d,晨起顿服,症状缓解后可以改为隔天7.5mg,共两周,然后每3天给7.5mg,共两周,最后可以停药。长期用药者的停药策略也可以按此进行。
即便是小剂量的糖皮质激素长期使用,也不能完全避免某些严重副作用的发生。在治疗前应向患者详细解释可能产生的后果,取得患者的充分理解。在治疗过程中,也需要严密监测以调整用药方案。糖皮质激素使用不当将产生严重的后果。Pincus和Corbett等学者指出,总体上来说使用糖皮质激素的RA患者死亡率增加。所以在决定对病人长期使用糖皮质激素之前要经过慎重考虑。
(2)局部用药:对于滑膜炎症状较重、受累关节少、全身治疗有禁忌的病人,可行关节腔内注射糖皮质激素,以缓解受累关节的疼痛、肿胀,抑制滑膜炎症状,改善关节功能。McCarty用关节内注射糖皮质激素加小夹板固定3周,每天松开小夹板,适当活动,发现新受损的关节数减少,但这种关节内注射不能改变病情进展,只是一种辅助治疗。
关节腔内注射药物的效果因人和关节部位不同而异。大多数病人的滑膜炎都能得到较好的控制。在RA病程的早期对数个病情严重的关节进行关节内注射,甚至可以产生全身性益处。注射剂量根据关节大小而调整,一般为10~30mg。美国风湿病学会提出的参考剂量为:手和足的小关节,泼尼松龙2.5~15mg混悬液或相应的药物;中等大小的关节如腕和肘关节,泼尼松龙10~20mg;膝、踝.肩关节,泼尼松龙20~50mg;髋关节,泼尼松龙25~50mg。一般情况下,同一个关节在3个月内只能注射1次,如果需要重复注射的次数过多或需要注射多个关节,说明需要调整这个治疗计划。还需要强调的是,在关节腔内注射糖皮质激素之前,必须排除其他原因引起的关节炎症。
7.生物治疗 类风湿关节炎是由免疫介导的慢性炎性疾病,其特点是滑膜细胞的增殖和炎症,伴随邻近关节组织的破坏。过去几十年对类风湿关节炎发病机制的研究又前进了一大步。由于发病机制研究的进展,治疗类风湿关节炎的方法也随之得到发展,尤其体现在当前热门的生物制剂方面,可谓方兴未艾。针对炎症反应的各个步骤而衍生的生物制剂如表34所示。
(1)T细胞作为治疗靶向:目前流行的观点认为,RA是由抗原激活的T细胞介导、T细胞浸润滑膜引起一系列的炎性反应,结
果导致血管和滑膜细胞增殖以及软骨和骨的破坏。也就是说,T细胞在RA异常体液和细胞免疫的启动和促进方面起着重要的作用,其证据为:RA滑膜下的大多数细胞都是T淋巴细胞,通过抑制T淋巴细胞的功能(包括胸导管引流、全淋巴结照射、淋巴细胞与
血浆提取法)可以改善RA的临床症状。因此,以T细胞为靶向的治疗目前研究的也比较多,下面分别作介绍。
①CD4抗原:CD4作为位于T细胞表面的分子,是抗原特异性T细胞受体(TCR)的辅助受体,在T细胞的激活和特异性免疫以及炎症反应的诱导方面起着重要的作用。使用抗CD4单克隆抗体治疗自身免疫性疾病是基于自身反应性T细胞在免疫反应中被抗原不断刺激的考虑。抗CD4单克隆抗体可能通过如下途径对免疫系统起抑制作用:
A.通过直接杀灭(补体介导或诱导凋亡)或对结合了抗体细胞的清除(补体或Fc受体介导的机制)来破坏CD4 T细胞。
B.依赖于抗体的细胞毒作用。
C.通过抑制CD4
T细胞与抗原递呈细胞(
APC)之间的反应,从而抑制依赖于Ⅱ型组织相容性复合体的T细胞反应。
D.向CD4 细胞传递抑制信号。
E.将激活的T细胞转为静息状态。
F.诱导从Th1模式向Th2模式转化。
鼠型抗CD4单克隆抗体曾经被用来评估对RA的疗效,但由于它本身的抗原性,应用受到限制,在此后的试验中,鼠型抗体就被嵌合型和人型抗体所取代。嵌合型抗体由人类抗体的恒定区和鼠型抗体的可变区融合而成,比单纯的鼠型抗体的免疫原性要小。为了进一步减少抗体的免疫原性,人类化的抗体仅仅使用了鼠型抗体的互补决定区(CDR),即高度可变区部分。
循环中抗CD4单克隆抗体的水平取决于注射的剂量和频率。对于嵌合型抗体来说,注射剂量超过10mg血清中才可能检测出非结合性抗体;以20mg剂量注射后,血清浓度峰值可达1~2mg/L,但24h后将测不出。单剂量注射10mg或更多抗CD4单克隆抗体,所有循环中的CD4 细胞都将被抗体结合,而关节内的CD4 T细胞与抗体结合得很少;只有使用50mg剂量连续5天注射后,关节滑膜液中的CD4 T细胞才会较多地与抗体结合。进入体内的抗体非特异性地在炎症部位聚集,除此之外在CD4 T细胞较多的组织中也含有较多的抗体。
最近对非消耗性(non-depleting)抗CD4单克隆抗体的临床研究发现,治疗组中73%的病人可达到ACR20,有32%的病人病情活动可以改善50%,外周血和滑膜液中CD4 细胞与抗体结合的比例与临床反应相关。对部分病人治疗前后的滑膜活检发现,治疗后滑膜液中肿瘤坏死因子和IL-6水平大大降低,同时T细胞、B细胞、巨噬细胞及黏附分子的表达也下降。这些提示抗CD4单克隆抗体治疗通过减少细胞因子对黏附分子的上调而抑制炎症反应。
抗CD4单克隆抗体的剂量在10~700mg/周时也不产生严重的毒副反应。治疗的主要副作用是发热、头痛和偶尔的血流动力学障碍,过敏反应即便使用鼠型抗体也很少见。尽管淋巴细胞减少可能会发生而且有时会较显著,但并没有报道感染和淋巴瘤发生的增加。
另一个非消耗性抗CD4单克隆抗体OKTcdr4a的效果已经在难治性RA病人身上得到了观察。这种抗CD4分子是将鼠型抗CD4(OKT4A)单克隆抗体的CDR部分镶嵌在人IgG4/kappa免疫球蛋白的可变区。在一个2期安慰剂对照试验中,36例难治性RA病
人参加了试验。接受大剂量(450mg/周)抗CD4单克隆抗体(OKTcdr4a)的病人治疗后得到临床缓解,提示单克隆抗体对炎症的抑制作用。C反应蛋白的水平在治疗后也得到降低。OKTcdr4a并不引起CD4
T细胞的消耗,CD4受体的饱和度依赖于抗体的剂量。
非消耗性抗CD4单克隆抗体的这些肯定的结果促使了对此类制剂的进一步研究,目前至少有两种这样的抗体正在进行临床试验。动物试验表明,临床反应依赖于治疗持续的时间和剂量,更多临床试验的开展将促使该治疗方法的合理性和安全性得到进一步的评估。抗CD4单克隆抗体与其他制剂的联合应用也是值得进一步研究的问题。
②以T细胞为靶向的其他抗体:其他针对T细胞的方法还包括抗CD52、抗CD5、抗IL-2受体和抗T细胞表面抗原的抗体。CD52是一种多肽,位于所有的淋巴细胞(B和T淋巴细胞)和一些单核细胞表面。CAMPATH-1H是一种人类化的抗CD52单克隆抗体,可以皮下注射或静脉使用。在一些临床试验中,部分病人得到显著的临床改善,但是外周血淋巴细胞(主要是CD4 淋巴细胞)的减少持续时间很长。尽管外周血淋巴细胞显著减少,一些病人病情的活动性仍然很强,而且从行关节置换的病人中可以发现,滑膜组织内仍然具有大量的CD4 T淋巴细胞。其他副作用还包括发热、皮疹和寒战。目前CAMPATH-1H已经不再被用于RA治疗。
CD5被发现位于所有的T细胞和部分B细胞表面,可能对T细胞受体介导的信号传导起负性调节作用。在一些开放性的试验中,抗CD5单克隆抗体的使用会引起外周T细胞数目的减少,并且T细胞对抗原和分裂素的增殖反应也会降低。但是其他进一步的试验并没有证实抗CD5单克隆抗体会带来显著的临床效果,因此目前这种制剂也不再被使用。
当T细胞被激活,一些特定的抗原包括高亲和性的IL-2受体(CD25、IL-2R)将被表达,这些抗原在静息的T细胞上并不存在。很多自身免疫疾病中(包括RA),激活的T细胞往往增加。针对IL-2R的治疗可以选择性地减少活性免疫反应而不干扰静息T细胞。目前已经用于试验的是IL-2分子与毒素(
白喉或假单胞毒素)的复合物和抗IL-2R单克隆抗体(抗CD25)。DAB486IL-2和DAB389IL-2都是IL-2R特异性细胞毒素,可以选择性地与IL-2R结合,并在受体介导下被T细胞内吞,内吞的细胞毒素将引起细胞死亡。但是随后进行的一系列临床试验并不令人鼓舞,只有小部分病人产生了一定的反应。
③以T细胞受体为靶向:T细胞通过其表面的受体(TCR)辨认抗原递呈细胞加工和递呈的抗原。T细胞受体属于免疫球蛋白超家族,大部分T细胞表达的是α/βTCR。如果滑膜中自身反应的T细胞只表达一个相对小范围的TCR,则选择性消灭这些淋巴细胞或让其失活应该可以减轻病情。一些研究者曾经报道,在RA滑膜液、滑膜组织和外周血中的T细胞表达相对小范围的TCR Vα或Vβ基因片段,但在不同的人其变化范围较大。同时也有一些报道证明T细胞为多克隆。造成这些研究的差异可能有很多原因,包括疾病的不同阶段、取材部位的不同及研究方法的不同等。以整个滑膜的T细胞群作为RA中淋巴细胞的特点也会引起结果的误解,因为其中只有一部分T细胞被激活,而大部分T细胞对于正在进行的免疫反应是不重要的。IL-2受体(CD25)是激活T细胞的标记,RA滑膜T细胞中大约有10%到15%表达此标记。对这些细胞的研究发现其TCR为单克隆扩增,主要是Vβ17、Vβ14和Vβ3。
使用减毒的病原或其衍生蛋白制成疫苗治疗感染性疾病早已为人所知。使用T细胞疫苗治疗T细胞介导的自身免疫疾病就是基于这样的假说,即对自身或外源性抗原特异的T细胞发动或参与了疾病的过程,它们的TCR可变区决定簇具有相对较小的范围。对于人类自身免疫疾病的动物模型的研究也发现致病T细胞确实具有相对小范围的TCR基因片段。
针对抗原特异性T细胞的疫苗在动物模型的应用,发现可以防止关节炎的发生,包括
胶原和抗原诱导的关节炎。由于人类自身免疫性疾病中大多数致病T细胞表达的Vβ基因成分比较局限,所以针对这些T细胞进行的治疗可以减少致病细胞的作用而不引起免疫抑制。TCR疫苗可以诱导自身反应性T细胞受体的耐受,引起它们的减少、抑制和失活。这些疫苗产生临床效果的机制比较复杂,可能与使用的蛋白肽有关,不仅是诱导产生抗TCR抗体,因为有的动物模型中并未检测到循环或结合的抗TCR抗体,且致病Vβ
亚群细胞也没有减少。
最初的疫苗来自于Vβ17的CDR2结构域的衍生肽。15例,具有中度到重度活动性RA的病
人参加了试验,试验剂量有10μg、30μg、100μg或300μg。在48周的观察期中可以见到临床症状的改善而没有见到副作用。随后的2期临床试验使用的是Vβ17、Vβ14和Vβ3衍生物的复合物。共99例病
人参加了试验,剂量有90μg和300μg,分别在0、4、8和20周时单剂量肌注,观察期为32周,此间没有病人因为副作用而退出。90μg剂量组中56%的病人在第3次注射后达到ACR20,50%在第4次注射后达到ACR20,而对照组为19%。300μg剂量组分别为25%和37%。尽管试验结果令人振奋,还有很多问题未曾解决,例如长期重复注射带来的一系列问题。临床应用还需要更大规模的研究和试验。
④辅助刺激分子:在一些动物模型中把辅助刺激分子(或其配体)作为自身免疫性疾病的治疗研究对象。目前这些分子有CD40、CD40配体(CD40L,也称CD154或gp39)、B7和CD28(B7配体)。CD154属于肿瘤坏死因子家族蛋白,是一种Ⅱ型细胞表面蛋白,由激活的T细胞表达。CD40是一种转导信号的受体,可以启动一系列的免疫和炎性反应,包括调节激活的T细胞,位于B细胞和激活的巨噬细胞上。
动物模型中使用抗CD154或抗CD40抗体都可以抑制CD40/CD154相互反应,并且短时间的应用就可以产生较长时间体液免疫反应的抑制。最近的证据提示,抑制CD40可以抑制RA滑膜中肿瘤坏死因子的产生,减少可以产生RF的B细胞。目前使用人类化的抗CD40单克隆抗体的临床试验正在进行。
激活T细胞需要的另一个信号是
APC上的B7相关分子与T细胞上的细胞毒性淋巴细胞相关克隆4(CTLA4-Ig)或CTLA4分子的相互作用。CD28是一个主要的辅助刺激分子,由静息的T细胞表达,B7是它的配体,位于激活的B细胞上。CTLA4(与CD28同源)也在一些激活的T细胞上表达,B7与它的亲和力是与CD28的20~100倍。将CTLA4的胞外部分与鼠IgG2a的Fc部分融合形成的融合蛋白(CTLA4-Ig)注射到动物体内可以防止B7与CD28的结合,防止
胶原诱导的关节炎的产生。在对银屑病病人的1期临床试验中,CTLA4-Ig治疗可以带来50%以上的临床改善。目前这种制剂正在RA病人中进行评估。
⑤主要组织相容性复合物拮抗剂:
APC对特异性T细胞的激活可以通过阻断
APC表面的T细胞识别结构而被阻止。Ⅱ型主要组织相容性复合物(MHC)就是这样的对象。直接针对疾病相关性Ⅱ型MHC等位基因产物的单克隆抗体已经在自身免疫疾病的动物模型中进行了测试,但引起治疗反应的机制还不十分清楚,这种效应不能归于Ⅱ型MHC的单纯阻断,因为治疗反应要在抗体注射很长时间后才出现。将从胎盘组织中提取的多克隆抗体注射到RA病人身上,大约50%的病人得到临床改善。使用鼠的抗HLA-DR/DP抗体可以在人体中诱导出内源性抗MHC抗体,这种治疗方法报道的显著临床改善可以持续至少6个月。最近将DR4/DR1肽作为疫苗来治疗RA,大约1/4的病人会产生抗体。另一种方法是构造一种蛋白肽可以阻断相应的Ⅱ型MHC等位基因特异的抗原呈递而不会减少B细胞,这种方法也不需要识别自身抗原。通过阻断疾病相关性Ⅱ型MHC等位基因(如DR4)治疗RA正在研究中。
(2)细胞因子的生物制剂:无论是体外还是体内试验都表明,细胞因子在RA的发病机制中起着重要的作用。尽管与RA有关的很多细胞因子的精确作用仍在研究中,目前发现IL-1和肿瘤坏死因子-α在RA的发病中起着非常重要的作用,因此这两个细胞因子成为研究RA治疗中最重要的目标。抑制这些细胞因子的制剂包括:①可溶性细胞因子受体;②细胞因子受体拮抗剂;③抗细胞因子单克隆抗体;④人类Fc结构与细胞因子或可溶性细胞因子受体的融合物;⑤对目标细胞因子具有反调节作用的细胞因子。其他的方法还包括阻止细胞因子的加工或合成等。
①抗肿瘤坏死因子-α制剂:肿瘤坏死因子-α是调节免疫系统内各个细胞相互作用的众多细胞因子之一,尽管很多细胞都可以产生肿瘤坏死因子-α,在炎症部位主要是由巨噬细胞(macrophage)产生。肿瘤坏死因子在1984年被克隆出来后,人们发现它与恶病质素(cachectin)是同一种分子,并且和淋巴毒素(lymphotoxin,LT)有大约30%同源。编码肿瘤坏死因子-α和LT(有时亦被称作肿瘤坏死因子-β)的基因在6号染色体上紧密相连。肿瘤坏死因子-α的前体是具有26kd的跨膜蛋白,肿瘤坏死因子-α转化酶可将其剪切成具有17kd的可溶性片段,该片段一旦从细胞膜释放就可聚集成同源三聚体。肿瘤坏死因子跨膜蛋白和可溶性形式都可产生生物学效应。肿瘤坏死因子-α受体有两种形式,p55(肿瘤坏死因子R-I,CD120a)和p75(肿瘤坏死因子-Ⅱ,CD120b),它们都具有胞内、胞外和跨膜区。胞外结构可被肿瘤坏死因子-α转化酶剪切下来形成可溶性肿瘤坏死因子受体,作为肿瘤坏死因子-α天然的抑制物。肿瘤坏死因子/肿瘤坏死因子R和Fas配体/Fas、CD40配体/CD40等都是同一家族的成员。
肿瘤坏死因子具有很多炎性和免疫反应活性,几乎参与炎性反应的所有环节,包括:
A.在血管系统的作用:a.通过激活NF-κB上调黏附分子受体活性(ICAM-1、VCAM-1、E-selectin);b.刺激血管生成;c.调节内皮细胞的促凝功能(刺激组织因子生成、下调血栓调节素)。
B.对炎性/免疫细胞的作用:a.免疫调节(激活淋巴细胞、中性粒细胞);b.诱导成纤维细胞增殖。
C.对反应介质的作用:a.诱导前炎性介质的合成(如:IL-1、IL-6、GM-CSF);b.诱导前炎性趋化因子的合成(如:RANTES、IL-8、MIP-1α、MCP-1);c.诱导其他炎性介质:前列腺素、白三烯、血小板活化因子、NO、活性氧物质等;d.诱导引起骨和软骨破坏的金属蛋白酶合成(如:
胶原酶、基质溶解素)。
D.其他效应:a.调节疼痛;b.引起恶病质;c.调节发热;d.使骨脱钙(“破骨细胞活化因子”活性)。
近十几年的研究表明,肿瘤坏死因子-α是产生类风湿滑膜炎关键的细胞因子,可能的证据是:a.肿瘤坏死因子-α的生物活性可以解释产生RA的病理过程,包括炎性细胞的聚集和激活、滑膜细胞的增殖、引起骨和软骨破坏的细胞因子和酶的浓度及活性的增加;b.RA滑膜组织中肿瘤坏死因子-α和肿瘤坏死因子-α受体上调;c.在体外,抗肿瘤坏死因子-α可以引起IL-1及其他前炎性细胞因子的下调;d.过分表达肿瘤坏死因子-α的转基因小鼠产生侵蚀性关节炎,其组织学特点与RA类似;e.关节炎的动物模型证实,抗肿瘤坏死因子-α物质可以减轻病变程度;f.对RA进行抗肿瘤坏死因子-α治疗可以产生较好的临床效果。
a.抗肿瘤坏死因子-α单克隆抗体:目前FDA批准的可以用于RA治疗的抗肿瘤坏死因子-α单克隆抗体有Centocor公司的infliximab(商品名
Remicade),这是20世纪90年代后期在美国首先被获准用于难治性RA病人的抗肿瘤坏死因子-α单克隆抗体。infliximab与甲氨蝶呤合用可减轻单用甲氨蝶呤无效的活动性RA病人的症状;2000年7月份FDA顾问小组推荐infliximab的扩大适应证为缓解RA病人的关节结构损害。
b.infliximab:infliximab(
Remicade)是鼠/人嵌合型抗肿瘤坏死因子-α单克隆抗体,属于IgG1型,也是用来选择性抑制肿瘤坏死因子-α的第一个制剂。infliximab由75%人和25%鼠的抗体组成,鼠抗肿瘤坏死因子-α抗体的可变区和人IgG1的恒定区融合构成完整的抗体(图43)。它可以与可溶性和膜结合型肿瘤坏死因子α结合,在体外研究发现能通过补体介导和抗体依赖细胞介导的细胞毒作用溶解产生肿瘤坏死因子α的细胞。infliximab半衰期为8~9.5天,使用时静脉滴注不少于2h。infliximab可以产生多种生物效应:抑制前炎性细胞因子;减少淋巴细胞在关节部位的聚集;减少滑膜的血管生成。infliximab减少血清IL-6和IL-1β水平,对滑膜活检的分析发现滑膜组织巨噬细胞产生IL-1β也减少。血清和滑膜组织表达的趋化因子IL-8和单核细胞趋化蛋白(MCP)-1的水平在用药后亦减少。infliximab同时可以减少滑膜组织中血管黏附分子E-selectin、细胞间细胞黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)的表达,血清中E-selectin和ICAM-1也减少。巨噬细胞炎性蛋白(MIP)-1α、MIP-1β和调节趋化因子生长的肿瘤基因α(Gro-α)在滑膜组织的水平没有发生变化,抗炎分子如可溶性肿瘤坏死因子-α受体(p75和p55)在治疗后迅速降低,尽管抗炎细胞因子IL-10会增加。内皮黏附分子和趋化因子对白细胞在受累关节的聚集起关键的作用,而infliximab对它们的抑制可以显著减少粒细胞、CD3
T细胞、B细胞和巨噬细胞在关节的聚集,同时外周白细胞、CD4
和CD8
T细胞水平会在治疗后很快上升。infliximab可以减少血管内皮细胞生长因子的浓度,从而减少滑膜新生血管形成。infliximab还可以减少
血浆NO合成酶、MMP-1(间质
胶原酶)和MMP-3(基质溶解素-1),而这些物质也被认为参与RA炎症和骨破坏的过程。
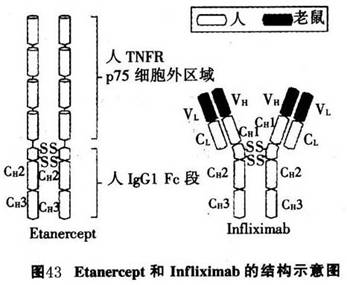
c.最初将infliximab作为单一药物进行的开放性随机临床实验发现,在给药的24h内,病人症状减轻的程度就可以达到60%,包括疼痛、晨僵和关节肿胀,2~4周效果达到最大。infliximab的效果呈剂量依赖性,1mg/kg的剂量时有44%的病人达到ACR20,10mg/kg的剂量时有79%的病人达到ACR20,中间有效期在1mg/kg和10mg/kg时分别为3周和8周。对infliximab的长期疗效的观察表明,在1mg/kg剂量单一药物的情况下,尽管有60%的病人在3周后达到ACR20,但是随着重复给药,其疗效并不能维持。而3mg/kg和10mg/kg剂量作为单一药物,疗效可以维持至少16周。1mg/kg、3mg/kg和10mg/kg分别与甲氨蝶呤联合使用时,疗效也可以维持,并且在后两种情况下经过14周的给药,停药后疗效仍可以维持12周。研究显示,小剂量的重复注射可以诱导产生较多的抗infliximab抗体,而较大的剂量和与甲氨蝶呤合用的情况下抗体产生较少。对于那些使用了甲氨蝶呤 15mg/kg剂量而反应不理想的RA病人,单用infliximab或与甲氨蝶呤联合使用,大多数都可以取得较好的疗效。时间更长、规模更大的临床观察显示,infliximab的使用可以显著减慢关节侵蚀和关节腔狭窄的进程,并且这种改善在那些临床症状的缓解并未达到ACR20的病人中亦可出现。当infliximab和甲氨蝶呤合用时,50%的病人甚至出现了关节破坏的停止,尽管病程已经很长。对428例甲氨蝶呤不敏感的病人进行的3期临床试验(ATTRACT试验)显示infliximab与甲氨蝶呤联合使用可以使这些病人获得显著的临床效果,并阻止关节破坏的进展。2年的追随发现疗效可以持续102周,并且infliximab大剂量具有更长疗效的趋势。这些结果已经在2000年11月举行的ACR第64届年会上公布。
d.infliximab的副作用有以下几个方面:输液反应:小部分病人在滴注后1~2h内发生了输液反应,包括发热、寒战、瘙痒、荨麻疹和心肺反应(胸痛、低血压、高血压和呼吸困难),严重的反应包括瘙痒、荨麻疹和心肺症状的发生率为0.5%。这些反应在对症处理或停止滴注后均可缓解。感染:在临床试验中,infliximab组中26%的病人发生了感染,安慰剂组为16%。最近来自于FDA关于用药后的市场调查表明,在大约6万例使用infliximab的病人中,发生结核(大部分为继发)14例,李斯特菌感染2例,链球菌感染7例,卡氏肺囊虫肺炎5例,疱疹病毒感染8例。同等情况下infliximab是否比传统的DMARDs增加感染的发生还没有经过临床证实。产生抗infliximab抗体:重复使用infliximab可以产生抗infliximab抗体,在临床试验中发生率大约是11%。较大剂量(3mg/kg、10mg/kg)和联合甲氨蝶呤使用比小剂量infliximab单独使用时产生抗体要少。自身抗体/类狼疮综合征:在大剂量甲氨蝶呤/infliximab联合使用时,26%的病人产生了抗核抗体,抗体类型是IgM,安慰剂组的发生率是6%。大约4%的病人产生了抗ds-D
NA抗体。极少数的病人产生了类似于系统性红斑狼疮的临床症状(类狼疮综合征),但没有产生肾脏和中枢神经系统的损害,停用infliximab和进行药物治疗后症状缓解。恶性肿瘤/淋巴增殖性疾病:在使用infliximab的病人中也有产生实体瘤和淋巴系统肿瘤的报道,但是没有证据表明infliximab会增加恶性肿瘤的发生。
e.FDA下属的关节炎顾问委员会最近建议infliximab和甲氨蝶呤联合使用以减少RA病人的关节破坏,用法为静脉滴注,起始3mg/kg,在第1、第2和第6周时各使用1次,然后每8周1次。具有活动性感染的病人不应使用,如果治疗过程中发生感染则应密切观察。目前infliximab在RA治疗策略中的地位仅限于和甲氨蝶呤联合使用,其作为单一药物使用和与其他免疫调节剂联合使用的价值还有待于进一步研究。
f.抗肿瘤坏死因子-α单克隆抗体的研究趋势:完全人类化的抗肿瘤坏死因子-α单克隆抗体:D2E7是通过重组D
NA技术生产的完全人类化的抗肿瘤坏死因子-α单克隆抗体。这种抗体具有一个与正常人类IgG1抗体相同的结构,对肿瘤坏死因子-α具有较高和特异的亲和力,可以中和与两种受体结合的肿瘤坏死因子-α。该药物的半衰期是6~13.7天,皮下注射或静脉滴注给药。临床观察发现,超过半数的病人可以达到ACR20,临床症状的缓解在治疗24h到1周内发生,1~2周后疗效达到最大,在剂量超过1mg/kg时剂量反应达到一个平台,一般情况下,最佳剂量是40mg。副反应中确定的是注射反应,感染和淋巴增殖性疾病的发生率并未比安慰剂组高。对该药12个月的观察也显示关节的破坏得到显著的减慢,并且耐受性良好。
聚乙二醇化(-PEG)的人类抗肿瘤坏死因子-α片段:CDP870是一种用高分子量的
聚乙二醇修饰的抗肿瘤坏死因子-α单克隆抗体片段,修饰的目的是为了延长抗体的
血浆半衰期。使用剂量分别为1mg/kg、5mg/kg和20mg/kg的CDP870治疗的病人在8周后达到ACR20的比例分别为25%、75%和75%,而安慰剂组为16.7%。进一步的2期和3期的临床试验正在计划中。
B.可溶性肿瘤坏死因子-α受体:目前上市的可溶性肿瘤坏死因子-α受体是Immunex/Wyeth-Ayerst公司的
依他普特(商品名enbrel),
依他普特用于一种或几种DMARD不太有效的中重度RA病人,后来又在美国被允许用于早期RA并延缓关节结构损害,目前正等待批准用于幼年RA。
a.
依他普特:
依他普特(enbrel)是运用基因工程产生的分子,其组成为两个人类75kd(p75)肿瘤坏死因子R的胞外部分,与人类IgG1的Fc部分相连,后者具有CH2和CH3结构域和铰链区。
依他普特可以与两个游离或结合型的肿瘤坏死因子结合,但不能使所结合的细胞溶解。
依他普特平均半衰期为4.8天(4.1~12.5天),使用时皮下注射,25mg每周2次。
在一个开放性临床观察中发现,
依他普特的使用可以减少激素或甲氨蝶呤的用量,少部分病人甚至可以停止激素或甲氨蝶呤的使用。在随访期间,副作用的发生
依他普特组与对照组并没有显著区别。这些结果已经在2000年11月举行的ACR第64届年会上公布。
依他普特的副作用有以下几个方面:注射部位的反应:大约有40%的病人在注射的部位出现轻度到中度的反应,通常在治疗3周后出现。这种反应持续的时间平均为4到5周,随着药物的继续使用反应将消失。也有的病人反应持续的时间比较长。感染:观察表明
依他普特和安慰剂组中感染的发生率和感染的类型没有显著的差别,在
依他普特和甲氨蝶呤的比较中,后者发生严重感染的几率比前者高。在FDA对超过2.5万例病人使用
依他普特最初5个月的调查中,30例被报告发生了严重的感染,包括几例脓毒血症。其中6例死亡,他们中的大多数都有慢性或复发性感染、之前存在的感染、糖尿病或其他容易引起感染的因素。最近FDA对大约8万例,使用
依他普特的病人的调查显示,结核感染1例,卡氏肺囊虫肺炎2例,链球菌感染11例,疱疹病毒感染108例。神经系统病变:数据显示使用
依他普特可能会诱导或加重脱髓鞘病变,中枢神经系统病变包括脱髓鞘病变,例如新近发生的或复发的多发性硬化、脊髓炎和视神经炎等。但是
依他普特和脱髓鞘病变的关系并不确定。曾经发生过脱髓鞘病变的病人在使用
依他普特时应予以充分的注意。血液系统:有的病例被报道发生了全血细胞减少,尤其在和其他会引起骨髓抑制的药物联合使用时,一般会在开始治疗的2周后发生。一旦发生严重的造血异常应该停止
依他普特的使用。产生抗
依他普特抗体:在16%的病人中至少发现出现过一次非中和性抗
依他普特抗体,此种抗体与治疗反应或副反应之间的关系还不确定。自身抗体/类狼疮综合征:使用
依他普特的病人中11%发现新产生的抗核抗体(安慰剂组为5%),15%的病人中发现产生了抗ds-D
NA抗体(安慰剂组为4%)。没有病人产生类狼疮综合征或其他自身免疫疾病的临床表现。恶性肿瘤/淋巴增殖性疾病:实体瘤的发生率和根据NIH的SEER数据预测值相似。没有证据表明淋巴瘤的发生会随
依他普特的使用而增加。
美国和欧洲都推荐在对甲氨蝶呤反应不佳的病人中可以单独使用
依他普特或与甲氨蝶呤联合使用,推荐用法为25mg皮下注射每周2次。鉴于DMARDs对轻度RA的疗效尚好,
依他普特多用于中度到重度的RA,大部分情况下都可以用于对甲氨蝶呤反应不好的病人。对早期RA的更为激进的治疗趋势暗示
依他普特在早期病程中的应用前景将会相当广阔,FDA最近推荐在早期RA中使用
依他普特以延缓关节损害的进展和改善病人的症状。但
依他普特联合甲氨蝶呤目前在早期RA治疗中还没有作为初治方案。所以
依他普特在治疗策略中的地位还应该进一步进行评估。如果进一步的临床观察表明
依他普特对怀孕没有副作用,则它可能会用于期望保留胎儿的孕妇。它用于小于4岁儿童的幼年RA的安全性还需要评估。
依他普特不应用于具有活动性感染的病人,如果在治疗观察中发生严重的感染或新出现的神经系统症状,则应该停用。
b.可溶性肿瘤坏死因子-α受体的研究趋势:lenercept由两个人类55kd的工型肿瘤坏死因子R的胞外部分和人类IgG1的Fc部分连接而成。临床观察发现该药疗效和甲氨蝶呤类似,副反应包括注射反应和轻度的上呼吸道感染。抗lenercept抗体的产生比较普遍,但并不带来对疗效的影响和副反应。产生抗核抗体和抗ds-D
NA抗体的比例分别为13%和3%。类狼疮综合征还未见报道。由于lenercept并不优于甲氨蝶呤,故其应用前景并不广阔。
聚乙二醇化的可溶性Ⅰ型肿瘤坏死因子R:
聚乙二醇连接于人类可溶性Ⅰ型肿瘤坏死因子R的N末端,该分子的二聚体具有对肿瘤坏死因子很高的亲和力。第一代药物的缺点是抗原性较强,重复给药将产生抗体,从而加快药物的清除和缩短药物的半衰期。第二代药物已经被研制出来,小规模的临床试验表明,从100μg/kg到1000μg/kg剂量其耐受性都很好,可以缓解临床症状,少数病人对药物产生了抗体,但没有见到临床效果明显的改变。这种药物的免疫原性、疗效和安全性正在被进一步评估中。动物模型显示该药物与IL受体拮抗剂联合应用产生的临床效果更好。
c.使用肿瘤坏死因子-α拮抗剂的联合治疗:尽管肿瘤坏死因子-α拮抗剂可以改善RA病人的症状,提高生活质量,缓解骨关节破坏的进展,但是并不能完全阻止疾病的进程。使用能够和肿瘤坏死因子-α拮抗剂起协同作用的药物可以增加疗效。因为甲氨蝶呤除了抑制肿瘤坏死因子-α外,对免疫系统还有多方面的作用,目前多主张联合使用甲氨蝶呤和肿瘤坏死因子-α拮抗剂,这样可能会带来更好的临床效果。ATTRACT临床试验所得到的数据显示了联合用药的优越性,这些结果已经公布。肿瘤坏死因子-α拮抗剂和CsA、抗CD4单克隆抗体、抗IL-12抗体和IL-1受体拮抗剂的联合应用也正在研究中。现在大多数的风湿病学家都不主张对初治的RA病人首选肿瘤坏死因子-α拮抗剂,使用抗肿瘤坏死因子制剂之前应使用甲氨蝶呤最低剂量15mg/周至少3个月(除非由于甲氨蝶呤毒性而不能使用),如果无效则可选用抗肿瘤坏死因子制剂。迄今为止,多数研究抗肿瘤坏死因子治疗的临床试验所选纳的对象都是病程较长,病情比较重,对甲氨蝶呤效果不好的RA病人。这些病人并不一定是使用抗肿瘤坏死因子治疗的最佳对象。所以对抗肿瘤坏死因子制剂在早期RA病人使用的研究是非常必要的,这种研究将进一步揭示抗肿瘤坏死因子治疗在RA治疗中的地位。
②抗IL-1制剂:
A.IL-1受体拮抗剂(IL-1Ra):IL-1基因家族包括IL-1α、IL-1β和IL-1Ra,其中IL-1α和IL-1β都是具有活性的分子,可以影响很多细胞的功能。IL-1Ra是IL-1的天然抑制物,可以从RA滑膜组织的巨噬细胞中检测到。IL-1Ra可以与IL-1受体结合,从而阻止IL-1与IL-1受体的结合,而且IL-1Ra与IL-1受体的结合不能向细胞内传递信号,也就启动不了由IL-1引发的一系列的下游反应。在体外,要获得完全抑制的效果,IL-1Ra的浓度必须是IL-1的10倍或100倍。动物试验中,重组的IL-1Ra(rIL-1Ra)可以阻止由IL-1诱导的一系列反应,包括滑膜细胞分泌PGE2、软骨细胞产生
胶原酶、蛋白多糖的退变和氨基葡聚糖合成的抑制。在IL-1Ra缺乏的小鼠模型中,可以观察到类似于RA的慢性关节炎的表现。
临床试验表明,rIL-1Ra与安慰剂比较可以产生显著的临床效果(一般在治疗2周后发生)和血清生化的反映(ESR和CRP降低),并且关节病变的进程也会显著减慢,主要是软骨退变的减慢。药代动力学发现,rIL-1Ra的半衰期为6h,生物利用度为95%(皮下注射)。由于rIL-1Ra在注射后的24h内循环浓度将很快下降,如果体内与体外一样需要IL-1Ra的浓度为IL-l的10倍或100倍才能抑制IL-1的活性,则每天给药将优于每周给药,临床试验也证明了这一点。对三组剂量:30mg/d、75mg/d和150mg/d的观察发现150mg/d的效果要优于其他两个剂量。一部分病人在治疗前后分别做了滑膜活检,结果发现,治疗后内膜层的巨噬细胞、内膜下的巨噬细胞和淋巴细胞显著减少,细胞黏附因子E选择素、血管细胞黏附分子1(VCAM-1)和细胞间黏附分子1(I-CAM-1)也得到了下调。
对rIL-1Ra和甲氨蝶呤联合应用的临床试验发现,在那些对甲氨蝶呤单独使用反应不佳的病人中,rIL-1Ra加上甲氨蝶呤可以取得满意的疗效,无论在临床症状还是在关节破坏的改善上均优于甲氨蝶呤独用,而且耐受性很好。联合治疗中rIL-1Ra的最佳剂量是1.0mg/(kg·d)。
目前所观察到的rIL-1Ra副作用很少,主要是注射部位的反应,发生率有62%(试验总人数为175例),由于不能耐受而中断治疗的只有5%。理论上rIL-1Ra具有潜在的免疫抑制的效应,但在临床中并未被观察到。体内rIL-1Ra并不减少外周淋巴细胞对外源性分裂素或抗原的增殖反应,也不抑制白细胞的反应。试验发现rIL-1Ra不会影响人体对抗原的细胞和体液免疫反应。rIL-1Ra也并不增加感染、淋巴增殖性疾病和其他恶性肿瘤的危险。
一些研究发现,连续的外周给药比一次注射带来的效果要好。每天皮下注射的给药方式并不能达到理想的血药浓度以使IL-1受体得到连续的中和。将来的发展方向是进一步改进给药方法或剂型以取得最佳的疗效。
有关rIL-1Ra制剂kineret(anakinra)的试验资料表明,kineret与甲氨蝶呤合用的RA病人有42%产生临床效果,而甲氨蝶呤单用只有23%有效。kineret对减少关节破坏有累积性效应,各种剂量的kineret都可以观察到关节侵蚀性损害及关节腔狭窄的显著改善。
B.可溶性IL-1受体(sIL-1Rs):IL-1α和IL-1β通过细胞膜上的IL-1受体起作用,IL-1受体有2种,分别是Ⅰ型和Ⅱ型。IL-l与Ⅱ型IL-1受体结合不能转导任何信号,所以Ⅱ型受体被称为“诱惑”受体。受体的胞外部分被剪切下来就形成了可溶性IL-1受体。Ⅱ型可溶性IL-1受体在RA病人的滑膜液中可检测到,这表明在慢性多关节炎中内源性Ⅱ型可溶性IL-1受体是一个自然产生的抗炎因子。但是由于它在体内的浓度很低,所以不足以产生临床上可观察到的抗炎作用。
重组的人类可溶性IL-l受体(rhu sIL-1Rs)可以特异性地结合IL-1,阻止IL-1与细胞表面正常的受体结合,从而产生了类似于抗IL-1抗体的作用。近期的一项临床实验表明,患者接受皮下或关节内注射Ⅰ型sIL-1受体治疗4周后,其症状与体征没有明显好转。研究发现,Ⅰ型rhu sIL-1R与IL-1Ra结合的比例多于IL-1β,这样在理论上Ⅰ型rhu sIL-1R将使IL-1β的作用增强,从而加重炎症的发展。不过在临床上并没有观察到症状加重的情况发生。
由于Ⅱ型rhu sIL-1R更倾向于和IL-1而不是IL-1Ra结合,所以可能会在临床上起到抗炎的作用。动物模型也表明Ⅱ型rhu sIL-1R可以显著减轻临床症状和组织学病变。目前这种制剂还没有用于人体。
C.干扰IL-1的加工和分泌:IL-1β被合成为无活性的前体存在于细胞质中。IL-1β的分泌伴随着白细胞介素转换酶(ICE)对它的加工。白细胞介素转换酶是一种细胞因子蛋白酶,将前IL-1β剪切为17kd的成熟形式。缺乏ICE基因的小鼠在脂多糖(LPS)的刺激下也不能产生IL-1β,同时亦会缺乏IL-1α,这种小鼠对
胶原诱导的关节炎也不敏感。预防性使用ICE抑制剂可以减少
胶原诱导的关节炎的发生,对已经发生的关节炎也可以减少其严重性(动物模型)。由于抑制ICE可以延长细胞生存时间,这样就能潜在地增加恶性肿瘤和自身免疫性疾病的发生,但在ICE敲除的动物模型中并未发现它们发生上述疾病的几率增加。ICE抑制剂尚处于动物试验阶段,应用于人体还需要很长时间。
③以其他细胞因子为靶向的治疗:
A.重组的干扰素:干扰素(interferon,IFN)是具有多种生物效应的细胞因子。IFN-α和IFN-β具有抗病毒和抗增殖的效应,IFN-γ除了这些作用外,还具有免疫调节的作用。在人类自身免疫病的治疗中,干扰素可能会占一席之地。
IFN-γ是T细胞衍生的细胞因子,可以诱导和增强Ⅱ型MHC抗原的表达,可能在RA的发病中起一定作用。在动物模型中注射重组的IFN-γ可以抑制滑膜中白细胞的聚集。IFN-γ可能通过抑制B细胞、减少循环中的中性粒细胞、抑制前炎性细胞因子的表达和抗增殖的机制起作用,从而改善RA的症状。然而,在大部分有安慰剂对照的试验中,IFN-γ只显示了非常微小的临床效果。所以目前已经不把IFN-γ作为RA治疗的研究药物。
已经发现重组的IFNβ-1b在多发性硬化中有一定的疗效,而且被FDA批准用于治疗多发性硬化。动物模型显示IFN-β可以显著减轻
胶原诱导的关节炎。小规模的临床试验发现部分RA病人可以取得一定的疗效,进一步的临床试验正在进行中。
B.IL-6:IL-6主要由T淋巴细胞、单核细胞和成纤维细胞产生,可以诱导B细胞分化、激活T淋巴细胞和诱导肝细胞合成急性期蛋白。肿瘤坏死因子-α和IL-1可以诱导IL-6表达。与肿瘤坏死因子-α和IL-1不同的是,IL-6不能刺激滑膜成纤维细胞产生PGE2和MMP-1(组织
胶原酶)。
动物模型揭示了IL-6的部分作用。在
胶原诱导的关节炎、新西兰鼠狼疮模型和抗原诱导的关节炎中发现了IL-6的参与。在这些模型中,使用单克隆抗体将IL-6中和后,关节炎较对照组减轻。IL-6缺乏的小鼠可以拖延
胶原诱导的关节炎的发生并能够减少其严重性。但是,IL-6缺乏的小鼠同时也显示了它肝脏的脆弱性。最近的数据暗示了IL-6可能具有抗炎作用。
由于IL-6在RA中的作用尚未研究透彻,因此在临床应用上针对IL-6的治疗受到很大的限制。因为需要进一步的安慰剂对照试验来明确抑制IL-6在RA中的治疗效果,所以针对IL-6的治疗提到议事日程上还需较长的时间。
C.IL-10:IL-10可以抑制巨噬细胞的很多功能,包括抑制IL-1α、IL-1β、IL-6、IL-8、肿瘤坏死因子-α、粒-巨噬细胞集落刺激因子、粒细胞集落刺激因子和MMP的产生。IL-10还可以刺激IL-1Ra、TIMP-1和可溶性肿瘤坏死因子受体。IL-10也可以抑制
过氧化氢和NO等的合成。研究还发现IL-10对T细胞和B细胞的功能都有抑制作用。总之,IL-10是一个具有抗炎作用的细胞因子,可以缓冲其他前炎性分子的作用。
动物试验也表明,使用重组的IL-10可以抑制
胶原诱导的关节炎的进程,解除蛋白多糖合成的抑制。IL-10与IL-4联合使用可以逆转软骨的退变,保护软骨并减少单核细胞在RA滑膜的聚集。在
胶原诱导的关节炎的动物模型中,单个关节腔内注射具有IL-10基因的载体病毒可以抑制关节炎的发展(包括非注射关节)。
到目前为止,已经完成了一部分评估IL-10在RA中疗效的临床试验。由于IL-10与甲氨蝶呤联合使用以及IL-10单独使用的临床试验并未发现其显著的效果,关于IL-10在RA治疗中的研究目前开展不多。
D.IL-4:IL-4同时具有抗炎、免疫调节和免疫刺激的特性。IL-4在调节Th细胞亚型的平衡中起重要作用,促进Th0细胞向Th2亚型转化。IL-4可以抑制单核细胞产生IL-6、IL-8、肿瘤坏死因子-α、IL-1和MMPs,抑制破骨细胞形成,同时刺激IL-1Ra的生成。
虽然在动物模型中观察到,重组的IL-4可以显著地抑制关节炎在慢性期的关节损坏,减少炎症细胞的聚集,减少血管翳的形成和关节侵蚀的发生。遗憾的是,在RA的临床试验中,重组的IL-4并没有产生显著的临床效果,因此目前该制剂没有继续成为治疗RA的研究对象。
E.IL-11:IL-11可以减少前炎性细胞因子和NO的产生。内源性IL-11由关节软骨细胞和滑膜细胞生成,它的功能包括刺激软骨和滑膜细胞生成TIMPs。体内和体外试验都表明IL-11可以产生抗炎作用,包括直接作用于激活的巨噬细胞。IL-11也能刺激一些急性期蛋白的产生,这种作用可能会降低它的抗炎作用。
1期和2期临床试验证实,接受15μg/kg剂量的病人可以产生病情活动的好转。关于IL-11的进一步研究正在进行中。
F.IL-12:IL-12是Th1亚群的诱导物,除了可以抗肿瘤、抗转移和抗血管生成以外,IL-12还能增强NK细胞活性,上调HLA-DR、黏附分子和前炎性细胞分子受体的表达,显著刺激IFN-γ的产生。缺乏IL-12表达或使用抗IL-12抗体的小鼠可以减轻关节炎的严重性。在病变后期将抗IL-12抗体和抗肿瘤坏死因子α抗体联合使用能够产生协同作用,显著抑制
胶原诱导的关节炎的发展。基于IL-12的生物学特性,抑制IL-12的方法可能会用于自身免疫病的治疗。抗IL-12单克隆抗体在RA治疗中的应用正在研究中,将来抗IL-12制剂的研究可能集中在与其他生物制剂联合使用上。
G.IL-13、IL-15、IL-16和IL-17:IL-13具有很多与IL-4相似的作用。在
胶原诱导的关节炎模型中,将转导了IL-13基因的细胞导入,可以产生抑制关节炎的效果。
IL-15可以诱导T细胞增殖和B细胞成熟,诱导T细胞产生肿瘤坏死因子,可以保护T细胞防止其凋亡。这些都提示IL-15可能会成为RA治疗的研究对象。
IL-16是CD4的配体,可以使表达CD4的细胞无反应。在动物模型中注射重组的IL-16可以显著减少滑膜的IFN-γ、IL-1β和肿瘤坏死因子-α。
IL-17由CD4 T细胞产生,可以诱导滑膜细胞产生炎性介质(IL-6、IL-8和PGE2等),也可以诱导巨噬细胞产生肿瘤坏死因子和IL-1β。IL-17被证明与软骨的破坏有关,包括减少蛋白多糖的合成。抑制IL-17的生成和活性可能成为治疗RA的一种手段。
H.分裂素激活的蛋白激酶:细胞在理化刺激下发生一系列反应,这些反应由细胞膜受体开始,激活相应的激酶,引起其他细胞因子和生长因子的表达,从而产生细胞免疫、炎症或凋亡行为。P38是蛋白激酶之一,它的激活可以上调肿瘤坏死因子、IL-1、IL-6、IL-8、氮氧化物和环氧酶-2的表达,因此通过抑制p38可能会引起这些前炎性产物的下调。在很多疾病模型中,p38抑制剂可以产生一定的效果,例如炎症、感染性休克和关节炎。一些p38的抑制剂正在被研究用于自身免疫病的治疗。
I.核因子kB(NF-kB):肿瘤坏死因子和IL-1与它们各自的受体结合在细胞内产生一个共同的激酶信号传递途径(NF-kB)。这可以解释为何肿瘤坏死因子和IL-1的生物效应具有重叠。这也提供了一种在受体后水平阻断这两种细胞因子作用的新的治疗途径。研究发现,糖皮质激素能够增加IkBa m
RNA的转录和IkBa蛋白的合成,这样可以减少NF-kB的含量。这也可能是糖皮质激素抗炎效果的重要机制。
体内试验已经证实了抗NF-kB在人类炎性疾病中的潜在治疗作用。外周或口服使用能够减少NF-kB的制剂可以降低动物模型关节炎的严重程度。
(3)以黏附分子和血管生成为治疗靶向:以黏附分子和血管生成为靶向的治疗具有广阔的前景。鼠型抗ICAM-1(细胞间黏附分子)单克隆抗体曾经被用来验证抗黏附分子的方法在RA治疗中的可行性。在一个开放性试验中,32例RA病人接受了不同剂量的鼠型抗ICAM-1单克隆抗体。结果显示有半数的病人临床症状得到了改善,而这些病人接受的剂量都比较大。早期RA的改善程度要优于病程较长的病人。在这些病人中,副反应的发生也很普遍,有头痛、发热、恶心、呕吐和皮肤反应。在治疗有效的病人身上,T淋巴细胞呈低反应性。由于人体对鼠型抗体产生抗体的反应普遍存在,故使用鼠型抗体的治疗受到限制。
CD44是hyaluronan(HA)的受体,也是可能被用在RA治疗中的一种黏附分子。在RA病人的关节内HA片段异常增高,这些片段的增高被认为是炎症部位白细胞介导的HA分子胞外降解的结果,可能作为疾病的生物标记。而且,HA片段具有促进血管生成的活性,这可能在RA的进展和持续方面起一定作用。例如,CD44与RA滑膜细胞的结合可以上调血管细胞黏附分子-1,也可能诱导和引起其他黏附分子的增殖。最近亦有证据说明,通过CD44将HA与巨噬细胞结合可以引起一些前炎性分子的表达。一些研究者已经报道抗CD44单克隆抗体在体内具有较强的抗炎作用,动物模型也发现它可以显著改善关节炎,而这种抗炎作用的发生与抗CD44单克隆抗体抑制白细胞聚集和激活的双重机制有关。
新生血管形成是RA关节中血管翳形成的重要机制。促进血管生成的特异因子目前还没有被确定。滑膜液和组织中富含促进血管生成的分子,包括IL-8、血管内皮生成因子、成纤维细胞生长因子和可溶性黏附分子(例如,E选择素、血管细胞黏附分子)。在
胶原诱导的关节炎中,血管生成的抑制剂(例如烟曲霉素衍生物A
GM-1470)可以成功地防止血管翳和新生血管的形成。整合素αVβ3是新生血管形成的重要辅助因子。在抗原诱导猫关节炎的早期,关节内注射整合素αVβ3的拮抗剂可以抑制滑膜血管生成,减少滑膜细胞浸润、血管翳形成和软骨侵蚀。除此之外,慢性关节炎中αVβ3拮抗剂的使用也可以有效地降低关节炎的严重程度。IL-8是对淋巴细胞和中性粒细胞起趋化作用的细胞因子,同时也具有促进血管生成作用,主要由滑膜巨噬细胞产生,在RA滑膜液中异常增多。肿瘤坏死因子和IL-1能够协同并促进滑膜成纤维细胞IL-8的表达和分泌。在猫的关节腔内持续注射IL-8可以引起严重的关节炎,所以抑制IL-8可能会减轻RA。
(4)补体抑制剂:补体链的激活可以产生很多活性副产物,它们可以具有免疫保护、免疫调节或促进炎症的特性。激活的终末补体成分C5a和C5b-9参与广泛范围的炎症反应。C5a是一个有力的趋化因子,可以调节多种炎症活性因子。抗C5单克隆抗体的出现目的是防止C5被剪切成具有炎性活性的副产物。在具有诱导的关节炎中,使用抗C5单克隆抗体可以抑制小鼠体内激活的终末补体,而免疫过的小鼠,其关节炎的发生也可以被阻止。对于RA和SLE,在人体使用人类抗C5a单克隆抗体的剂量和安全试验已经完成,没有观察到明显的毒性。这种单克隆抗体的2期临床试验正在进行。
(5)细胞凋亡:在RA中,T细胞生存的机制到目前尚未了解透彻。最近的数据提示CD4 /CD28-的T细胞以Bcl-2的上调为特征。Bcl-2是一种生存蛋白,可能会促进自身反应性T细胞的克隆性生长。在RA滑膜中,Fas敏感的T细胞可以辨认相对受限的T细胞对自身抗原的表位,这提示对抗fas的敏感性可能是RA中被激活T细胞的选择标记。有趣的是,甲氨蝶呤最近显示可以通过独立于CD95的途径来选择性地破坏外周血T细胞。在RA和其他自身免疫性疾病中,凋亡的机制还需要进一步研究。
增加滑膜细胞的凋亡是RA治疗的另一个途径。凋亡的增强可以至少部分减慢滑膜增殖的进程。Fas(CD95)分子是在正常和增殖细胞表面表达的受体,包括滑膜细胞。Fas与抗Fas单克隆抗体或Fas配体交联将诱导细胞凋亡。在动物模型中,将抗Fas抗体或表达Fas配体的病毒载体注射入关节腔内,短时间内关节肿胀的症状很快即可消失,证实了滑膜凋亡的增强和炎症的减轻。在关节炎动物中转导入CD95配体基因也显示同样的结果。所以,增强滑膜细胞的凋亡可以作为RA的治疗方法之一。
(6)金属蛋白酶抑制剂:RA中软骨和骨的破坏是间质MMPs(金属蛋白酶)作用的结果,这种酶是由激活的滑膜细胞和浸润的巨噬细胞产生的。抗肿瘤坏死因子和抗IL-1可以通过抑制炎性细胞从而减少MMPs的产生。其他药物,例如糖皮质激素和甲氨蝶呤也可以减少MMPs的表达。
在Ⅱ型
胶原诱导的关节炎中,腹膜内注射TIMP-1可以显著降低关节炎的严重程度。但是,是否外源性TIMPs的注射会产生治疗作用并不十分肯定,因为在蛋白多糖被清除前,TIMPs能够穿透而进入软骨的量很少。另一种方法是通过使用类维生素A等来增加局部TIMPs的含量。
四环素可以抑制间质
胶原酶、明蚀酶和
弹性蛋白酶,其类似物(如米诺环素)也具有相同的特性。对小部分早期RA病人长达4年的临床观察表明,使用米诺环素组中更多的病人得到缓解。可以特异性地抑制MMPs的合成肽正在研究中。
8.类风湿关节炎的治疗策略 类风湿关节炎的治疗是多方面的,包括教育、物理康复、饮食、药物、外科和心理治疗。有学者认为在类风湿关节炎病程的不同阶段,治疗的侧重点有所不同,为简单起见,人为地将RA的病程划分为明确诊断RA前、确诊RA、晚期RA和难治性RA几个时期进行分述。
(1)明确诊断类风湿关节炎前:新近发生的关节肿痛和僵直可能是某种慢性疾病的表现之一,也可能是自限性病程。这类病人只有少部分最终会发展成RA,大约超过一半的人会完全缓解。有人统计过1994年美国马萨诸塞州HMO医院内RA病人从发病到被诊断所需的时间平均为36周。这么长的时间间隔与病人和临床医生的态度都有关系:一方面病人不愿意因为一些小问题去看病;另一方面临床医生不愿很早就给病人戴上RA的帽子。需要强调的是,即使没有确诊也需要进行积极有效的治疗。
在明确诊断之前,药物治疗的目的主要是镇痛,可以使用镇痛药或非类固醇抗炎药。对乙酰氨基酚(扑热息痛)的用量国外报道在没有肝病的情况下每
天可以用到3g或更多。对乙酰氨基酚与可待因或其他麻醉药合用镇痛效果更佳。此类药物单独连续使用不应超过6周。
非类固醇抗炎药在未分化多关节炎中使用也较多。国外有的研究表明:阿司匹林在同类药中副作用较小、比较安全,非乙酰化
水杨酸(如水杨酰
水杨酸)安全性更好,它们都适合长期使用。非类固醇抗炎药使用时要注意胃肠道的副作用,对耐受性较差的患者可选用特异COX-2抑制剂如
塞来昔布(celecoxib)等。一般使用此类药物都不主张用到最大量,理由是:①大剂量NSAIDs副作用较多。②如果中等剂量NSAIDs对症状控制不满意,则患者有可能发展成RA或其他慢性疾病,此时便需要相应的治疗,故不需要使用最大剂量的NSAIDs来控制症状。
激素一般不主张在此类病人中使用,因为短期使用者症状虽可缓解很快,但是容易掩盖病情,长期使用副作用较大。
治疗应与检查同时进行,以期及早发现可能的病因。
同时医生应该教育病人,对于炎症关节来说,过度运动固然可以加重炎症,但适当的运动可以避免过早丧失关节功能,所以最重要的是找到运动和休息的最佳平衡。最疼痛的关节即便是在夹板固定的情况下也必须进行被动运动,以防止屈肌挛缩。对中度炎症的关节而言,肌肉进行等长收缩可以产生足够的肌张力而不加重关节炎的症状。每天进行几次持续6s的最大收缩可以防止关节周围肌肉萎缩。对关节炎症不活动和控制满意的病人可以进行适当的力量训练,能够显著改善肌力、疼痛和疲劳。
(2)对已确诊类风湿关节炎的治疗:当患者的临床表现、实验室检查和影像学表现已经能够明确诊断RA时,治疗仍然以药物为主,同时配合对病人的教育、康复、外科和心理等多种手段。
①药物治疗的方案:
A.早期治疗:研究表明,在RA开始几个月内很多具有持续活动性滑膜炎的病人会出现关节软骨不可逆的损坏,大部分病人在1年内发生,而且关节最大破坏程度的50%发生在疾病的前5年内。迄今为止,多数临床试验都支持早期积极的治疗(early aggressive therapy)可以更好地改善RA的结局。Pincus使用下面4个证据总结了对RA早期进行有效和积极干预的原因:
a.20世纪80年代的研究表明,大部分诊断为RA的病人在5~20年内关节功能和工作能力呈进行性下降,同时病死率上升。
b.大部分病人关节的骨侵蚀和关节腔的变窄发生在起病的最初2年内,并在以后的时间内呈进行性发展。在最初的2年内影像学上所示的恶化速度大于后几年。一旦增殖的滑膜开始侵犯和破坏关节软骨,关节就处于不可逆性破坏的危险之中,即便以后疾病活动性降低。
c.类风湿关节炎的病死率
可由临床状况预测,并与其直接对应。疾病的活动性和严重性越高,结局越差。
d.在过去,病程超过2年的RA病人使用传统的方法治疗,只有少部分病人的病情可以有效控制。所以,目前对于风湿病学家和临床医生来说,治疗RA的挑战在于尽可能早地开始实施治疗,以缩短疾病的进程。因此,美国风湿病学学会的《类风湿关节炎治疗指南2002版》中建议RA病人如果具有持续的关节痛、晨僵、疲劳、滑膜炎或ESR及CRP升高,则应该在不超过3个月的时间内使用DMARD药。同时应避免治疗副作用的发生和甚至由此引起的死亡。
因此,美国风湿病学学会的《类风湿关节炎治疗指南2002版》中建议RA病人如果具有持续的关节痛、晨僵、疲劳、滑膜炎或ESR及CRP升高,则应该在不超过3个月的时间内使用DMARDs,对于关节检查或影像学证明存在持续的滑膜炎和关节损坏的未曾治疗过的病人应立即使用DMARDs。
对早期RA是否需要联合用药尚存在一些争论,有学者认为有的早期RA使用单种药物即可控制症状,如果采用联合用药,疗效不一定会增加,反而会增加副作用;而有的学者认为早期RA的治疗非常重要,这一时期滑膜炎的缓解程度将对整个预后产生重要影响,所以主张联合用药以达到关节滑膜炎症的最大缓解。1997年Boer等就证明在早期RA中联合使用甲氨蝶呤、柳氮磺吡啶和泼尼松的下台阶方案(泼尼松起始量为60mg/d,在几周内迅速减量到7.5mg/d,并在第28周时停用;甲氨蝶呤剂量为7.5mg/d,在第40周停用。)效果要优于单用柳氮磺吡啶,尽管泼尼松和甲氨蝶呤都停用后两组在临床症状控制上效果相仿,但是联合用药组,4年以后关节破坏的程度,明显比单独用药组轻。Mottonnen也发现在早期RA中甲氨蝶呤、柳氮磺吡啶和HCQ联合使用效果优于DMARDs单独使用。根据这些临床试验的结果,目前倾向于对大部分RA病人开始就使用联合治疗,至于采用下台阶方案还是快速上台阶方案,尚无定论,还需要进行更深入的临床试验。对早期RA使用生物制剂联合甲氨蝶呤治疗的小规模研究发现,无论在临床症状的控制上,还是在减慢关节破坏的进展上,联合用药都要优于甲氨蝶呤单用。由于缺少大规模的临床试验和长期观察,此类方案目前还没有得到ACR的正式推荐。
B.治疗RA首选DMARDs:人们已经认识到尽早使用DMARDs可以防止和减轻关节破坏,保护关节的功能,并且在关节发生破坏前使用效果更好。由于RA并不总能在早期阶段得到诊断,怎样把握使用DMARDs的时间呢?美国风湿病学学会在《类风湿关节炎治疗指南2002版》中指出,对于一个已经确诊的RA患者,如果使用足量的NSAIDs仍然存在持续的关节痛、严重的晨僵和疲劳、活动性滑膜炎、ESR或CRP水平持续升高、放射学检查显示关节破坏,则DMARDs的使用最多不应拖后3个月;对任何未经过治疗的病人如果具有持续的滑膜炎和关节破坏,应立即使用DMARDs以防止或减慢关节的进一步破坏。
现在欧美国家比较常用的DMARDs有甲氨蝶呤、
羟氯喹、柳氮磺吡啶、来氟米特、
依他普特和infliximab;使用较少的有硫唑嘌呤、青霉胺(D-青霉胺)、金制剂、米诺环素和环孢素A。这些药物的选用受很多因素的影响,基于安全、方便和费用的考虑,欧洲的风湿病学家大多首先选用
羟氯喹和柳氮磺吡啶,而北美的风湿病学家首先选用甲氨蝶呤,对于一个病情很活动或预后很不好的患者,则推荐使用甲氨蝶呤或联合治疗。各种药物的大致情况见表35。
对于DMARDs单药之间进行比较的临床试验不是很多,近年的研究发现,在所有的DMARDs中,没有哪一个药优于甲氨蝶呤(包括效果、副作用、依从性和费用等),故甲氨蝶呤目前在DMARDs中占有重要的地位,甚至成为评估其他药物疗效时的比较标准。
C.DMARDs的联合治疗:如果使用单个DMARDs不能满意地控制临床症状或防止病情进展,则倾向于DMARDs药物的联合使用。联合用药有3种情况:a.开始时使用几种DMARDs以取得病情的最大缓解,待病情稳定后逐渐减去一些药物,以期能用最少的药物维持,这就是所谓的下台阶方案(step-down);b.开始时使用一种DMARDs,如果症状控制不满意,则逐步添加其他的DMARDs,直到病情被控制为止,此为上台阶方案(step-up);c.一开始就使用两种或更多的DMARDs药物并持续使用,只进行剂量上的调整,这是平行方案(parallel approach)。到底使用哪一种方案目前还存在一些争论,无论使用何种方案,强调的都是药物的联合使用;无论使用哪种方案,其目的都是期望效果增加而副作用减少。由于甲氨蝶呤在治疗RA中的显著优越性,目前多主张将其作为联合用药的基础(corner stone)。
联合治疗主要用于病程较长和难治性(指已经至少足量使用两种DMARDs,尤其是甲氨蝶呤和柳氮磺吡啶,而效果不佳)RA患者,研究表明甲氨蝶呤、柳氮磺吡啶和HCQ三者联合使用的效果要优于这3种药两两联合,而两两联合的效果又要优于单药独用,并且联合用药的副作用与单药使用没有显著差别。Tugwell等也发现甲氨蝶呤和环孢素A合用效果优于甲氨蝶呤或环孢素A单独使用,但是长期随访发现有高血压的发生和血肌酐水平的升高。最近的研究发现,生物制剂和甲氨蝶呤联合使用对难治性RA的短期疗效很好,并且副作用也非常小,长期疗效还在观察中。不过,目前对早期RA是否需要联合用药尚存在一些争论(表36,37)。
②治疗RA的处理流程和治疗指南:美国风湿病学学会《类风湿关节炎治疗指南2002》对类风湿关节炎的处理流程如图44所示。
北美的风湿病学家在1999年和2000年分别集中在一起,评估和讨论了RA的治疗现状,并达成了一些共识,为21世纪初RA的治疗提供了一个指南。这些共识包括:
A.治疗RA最根本的目标是消除滑膜炎和疾病的活动性。
B.除了少数病人,所有的病人都应该使用DMARDs或生物制剂。因为考虑到少数病人的年龄、意愿、药物来源和非常受限的疾病活动性,所以他们可暂不用这两类药治疗。
C.当病情活动时,不管病程长短和病人年龄,应施行治疗建议所推荐的措施。
D.首先使用最有效的DMARDs。
E.在美国最普遍使用的DMARDs是甲氨蝶呤,据统计包含甲氨蝶呤或与其等效药物的治疗计划在最初的临床评估中对85%的RA病人是适合的。
F.DMARDs应该被用到足够剂量,除非在小剂量时已经达到满意的治疗效果或受已经发生的副作用的限制。对甲氨蝶呤来说足够剂量为至少20mg/周,柳氮磺吡啶为3g/d。
G.治疗应该尽早开始。通常需要就诊一两次后才能对RA作出最初评估。有时在等待实验室的结果这段时间内不予任何处理,和(或)观察患者对第1次就诊时给予治疗的反应都是可行的。但是这种等待应该根据实际情况安排,在第1次就诊时给予特异的治疗可能是恰当的。
H.如果疾病的活动性不能得到充分的控制,则说明当时的治疗失败。
I.一般来说,DMARDs足够的作用时间分别是注射金制剂5个月,青霉胺6个月,
羟氯喹4个月,其他DMARD和生物制剂3个月。不过有时药物完全产生作用需要的时间比上述要长。如果临床上随着时间的延长,药物的疗效逐渐增强,则等待可能是恰当的。
J.当不能满意地控制病情时,应该换用或增加其他DMARDs或生物制剂。
K.DMARDs或生物制剂的使用也有一个阶梯。如果患者对甲氨蝶呤或来氟米特的疗效不佳,则对其他的DMARDs也不会有好的疗效。在这种情况下可能需要改用或增加生物制剂而无需更换其他DMARDs。还可以使用甲氨蝶呤 HCQ 柳氮磺吡啶三联或甲氨蝶呤 CsA二联治疗。
L.大多数患者对DMARDs或生物制剂治疗不能完全有效,这类病人应给予最有效的治疗措施,而继续改换其他DMARDs并不是好的治疗策略。
M.在治疗过程中,根据病情和治疗反应使用生物制剂可能是适当的。对于进展性RA或DMARDs治疗无效时,则不应使用抗细胞因子治疗。它们适用于治疗快速进行性、浸润性疾病。
N.在使用DMARDs时应该考虑到预后因素,包括疾病放射学的进展。
0.作用较弱(
金诺芬)和毒性较大的DMARDs已经很少使用,也不推荐使用。
P.糖皮质激素由于它的副作用,其使用仍然存在争论,但是很多风湿病专家相信小剂量(10mg)是有效而安全的。
Q.并不要求使用NSAID和(或)简单的镇痛剂,但是这是一种辅助治疗对有些病人是合适的。
R.所有的治疗方案必须考虑到病人的医学、社会、心理和经济状态。病人的意愿非常重要。
S.使用药物时应该告知病人治疗将产生的副作用。
T.在治疗前和评价治疗的效果时,需要对病情活动性进行专门的评估。评估程序应该以ACR的核心标准为模式,至少要包括对疼痛、总体严重性、功能、急性期反应物和关节计数的评估。
③其他治疗:
A.教育:一项研究表明,RA的病死率与病人的教育程度成反比,这个结果不能用年龄、病程、关节计数、功能测量和药物来解释。尽管教育程度与RA转归之间的联系还不是很明确,但是教育病人了解类风湿关节炎的危害性、怎样寻求帮助和采用的治疗方法,会带来更好的预后。美国在此类病人中推行《关节炎自我处理程序》(ASMP)之后,发现病人疼痛程度减低,可以减少看病次数,减少花费。心理咨询可以缓解病人的压力,增加其心理抵抗力。总之,使患者感到自己正在积极控制疾病,并参与到治疗之中。国内目前在这方面的工作还很欠缺,客观上由于病人很多、难以顾及,有的医师对此也不够重视。随着就医环境的改善和病人教育水平的提高,病人对这方面的要求也会随之增加。
B.康复治疗:滑膜炎早期阶段的界定很重要,在这个阶段应让患者知道如何正确使用关节,以避免加重关节的破坏。康复疗法基本的原则是尽可能避免在承重和非承重关节施加过度的力量。这一点对承重关节来说就是避免不和谐的碰撞,以及在承重时肌肉的过分用力和重复的收缩。对非承重关节来说关键是避免力量过大的肌肉收缩。因为抓取小物件时更需要力量,所以患有活动性滑膜炎的病人更适合使用具有较大周径的工具,并尽量使用双手。另一个基本的注意事项是尽可能避免重复动作,因为那样可以加重重力对关节的影响。研究表明,恰当的运动可以增强患者完成日常活动的能力,减少疲劳的程度,改善对病情严重性的总体评估和心理状态,并且可以增加疼痛耐受性。
C.饮食疗法:人们一直在寻找饮食与类风湿关节炎症状的产生、加重或缓解之间的关系,以期通过调整患者的饮食除去对疾病不利的因素,进而减少甚至停止用药。关于这方面的研究已经进行了很多,但是目前在有些方面还存在争论。
不饱和长链脂肪酸,如
鱼油、夜樱草油等,以及某些微量元素如硒等,可使RA患者的症状缓解。不仅能减少疼痛和肿胀的关节数目,而且可以减少晨僵时间,增强握力,延缓疲劳等,但是这样做并不能改变病程。
已知能量缺乏可以影响免疫反应,接受饮食治疗的RA病人常有体重减轻,这是因为脂肪摄入量减少的缘故。热能减少造成免疫反应受到抑制,有利于RA症状的缓解。必须强调的是,至今尚无充分的证据说明饮食治疗可以转变RA的病程,所以该治疗只能看作辅助措施。同时,调整饮食也是预防症状复发的手段之一。
D.外科治疗:类风湿关节炎的手术治疗分为两大类:预防性手术和重建性(抢救)手术。在病程的不同阶段进行不同的手术。
需要强调的是,在对病人开始治疗时就应该有外科医生参与,在病程的不同阶段共同制定相应的治疗计划。当RA病人出现难以控制的疼痛、活动范围的限制或关节功能的限制时,都可以考虑手术干预。早期采取预防性手术有助于改善关节功能。
F.心理治疗:类风湿关节炎疾病是一种慢性疾病,并且可以涉及全身多个器官、系统,治疗比较困难,常常迁延不愈,不但在生理上而且在心理上给患者带来痛苦,影响患者的生活和工作。心理因素可以通过神经-内分泌系统直接作用于免疫系统,导致其功能紊乱,引起风湿性疾病,也可以通过认知、行为、情绪影响疾病的症状变化、疾病转归,影响治疗和愈后。由于传统的医学模式已经向生物-心理-社会这一新型医学模式转变,心理治疗日益受到重视,也成为继药物治疗、手术治疗和康复治疗之后一种重要的治疗方式。斯坦福大学的Kate Lorig等设计的自助教育方案(self-help education management)可有效地增加患者关于风湿性疾病的知识并减少疼痛。另一个方案即针对慢性疾病的认知行为疗法(cognition-behavior treatment,CBT)主要用于缓解疼痛及治疗类风湿关节炎。这两个方案在临床上常被整合在一起用于治疗,被证实对缓解风湿性疾病患者的症状、提高生活质量有确定效果。
(3)晚期类风湿关节炎的治疗:当病人因为长期治疗不当造成关节畸形以及其他并发症时,治疗的重点根据疾病的活动情况而不同。
晚期RA有一个特点,即“燃尽现象(burning-up)”,也就是说,从症状上看,病人的关节肿胀、疼痛明显减轻,但是其他表现如晨僵、疲惫感和贫血仍然持续加重。实际上此时炎症仍很活跃,应该给予积极的治疗。不过与上面不同的是,由于病人病程很长,各脏器的功能相对较差,所以要特别注意监测治疗药物副作用的指标。
如果患者病情平稳,那么治疗的重点放在如何减轻关节的畸形。这时主要的治疗手段是物理康复和外科治疗。康复治疗可以按照以下原则和建议进行:
①在任何康复疗法中首先考虑控制疼痛。
②与一定目标相应的治疗方法应尽可能简洁并易于实施。
③对患者进行充分的教育使之明白治疗的目的,提高患者的依从性。
④休息和制动可以减轻炎症,但同时也促进肌肉的挛缩和无力。休息必须和适当的运动相平衡。
⑤关节保护原则:A.关节在夹板固定、休息或活动时都必须摆正位置以避免变形;B.教育患者在体位变换时注意最佳身体独立性、关节保护、安全和省力;C.活动时在可能的范围内应使用最强壮的关节;D.计划和施行动作时应将关节的过久和过度使用减到最小,同时应注意省力。
⑥运动疗法有很多目标,通常通过特殊的动作只有一个目标被最佳地完成。这些目标包括:A.保持功能;B.恢复功能;C.增加力量和静态耐力;D.增加运动耐力;E.增强良好的自我感觉;F.提供心血管方面的训练;G.提供运动、娱乐。
⑦使用夹板应该是为了缓解疼痛和改善功能,除非是为了术后特殊的体位或回复已经发生的挛缩而暂时使用。
⑧康复治疗的阶梯一般是:A.控制疼痛;B.恢复关节正常位置;C.恢复力量;D.恢复功能。
这个时期的外科治疗以重建手术为主,重建手术是对已经产生了骨质破坏的关节而言,主要有关节固定术和关节成形术。很多关节的关节固定术由于难度较大,现已几乎被抛弃。有些关节,如腕关节和中间跗骨关节的融合对解除疼痛和改善功能很有效,目前还在进行。由于假体材料和粘固剂的改进,关节成形术实际已经演变为关节置换术。
(4)难治性类风湿关节炎的治疗:难治性RA的治疗相对较为棘手,不过随着生物技术的发展,目前治疗的手段较以前已经丰富了许多。近年来新出现的生物制剂、造血干细胞移植等方法,为难治性RA患者带来一线希望。不过,其中有些技术并不十分成熟。但是我们相信,不久的未来难治性RA一定会被征服。
有学者建议对难治性RA(或对甲氨蝶呤效果不好者)的治疗可以采用如下方案(表38)。
9.RA治疗的发展方向
(1)基因治疗:目前认为细胞因子在RA的发病过程中起着重要的作用,尤其是IL-1和肿瘤坏死因子-α等。无论是在动物模型还是在RA患者身上都发现,在受累关节腔内可以检测出可溶性IL-1受体(sIL-1R)和可溶性肿瘤坏死因子-α受体(s肿瘤坏死因子α-R)。这些物质可以阻止IL-1和肿瘤坏死因子-α与各自的靶细胞受体结合,所以是一种保护性的物质。但是,由机体自发产生的这些物质含量很少,不足以抵抗IL-1和肿瘤坏死因子α所引发的一系列反应。如果能让机体产生足量的此类物质,就可以减轻甚至阻断RA的进展过程,而且这些内源性的物质比现在所有治疗RA的药物所引起的副作用都要小得多。在这种情况下,基因治疗应运而生。
基因治疗的原理就是,将对RA有治疗作用的蛋白质的基因编码导入特殊的细胞内,使其长期高效表达一定水平的这些蛋白质,达到治疗的目的。目前基因导入的方法有两大类:一种是将特殊的细胞提取后,在体外导入一定的基因,经过增殖扩充后再将其输入体内;另一种就是直接将载有一定基因的特殊载体引入体内,在体内进入特殊的细胞。现在对RA进行基因治疗的一个吸引人的策略就是将抗关节炎基因(anti-arthritis gene)转移到受累关节的滑膜层细胞中(synovial lining)。在体内和体外方法中应用的载体不同。在体外,反转录病毒介导的基因转移是一个可靠的技术,在兔的关节内可以带来超过6周的关节内基因表达,而不引起炎症和其他副作用。在兔的抗原诱导的关节炎模型、猫链球菌细胞壁诱导的关节炎模型、鼠
胶原和
酵母多糖诱导的关节炎模型中,以该种方式将编码IL-l受体拮抗剂(IL-1Ra)的基因导入可以对关节产生部分保护作用。
在体内,将基因导入到关节的滑膜层细胞可以通过腺病毒、AAV(adenoassociated virus)、脂质体和裸D
NA。使用这些载体,编码可溶性IL-1受体Ⅰ(sIL-1RⅠ)的基因在兔的
胶原诱导的关节炎模型中显示了显著的抗关节炎活性。使用腺病毒局部导入病毒IL-10(vIL-10)在鼠
胶原诱导的关节炎模型中也显示了抗关节炎活性。有趣的是,在实验中意外发现,sIL-1RⅡ和vIL-10基因的导入不但在注射关节,而且在非注射关节都能抑制疾病的活性。
除了导入抗炎和免疫调节细胞因子的基因外,还能导入其产物可以被删除的基因。例如,将疱疹胸苷激酶基因导入,这样给予更昔洛韦就可以杀死滑膜内和滑膜周围的细胞,即利用更昔洛韦杀死与疱疹胸腺激酶基因产物结合的细胞,实际是药物性滑模切除。尽管有足够数目的正在分化的滑膜细胞可以被有效地杀死,但还不知道这种类型的“基因滑膜切除”比传统的滑膜切除具有什么优点。这种方法已经研究了多年,但是长期的结果还是比较含糊。fas配位(fas L)基因的导入也是研究的一个方向。并且在这种情况下,被转导的滑膜细胞通过fas受体同时具有选择性杀死关节炎相关性T淋巴细胞的能力,因此可以更有效的控制病情。Kobayashi等发现fas相关性死亡结构域蛋白(F
ADD)在fas介导的滑膜细胞凋亡中起关键的作用。通过腺病毒在培养的RA滑膜细胞中转染F
ADD基因可以诱导F
ADD表达的上调和凋亡。在移植了人类RA滑膜细胞的严重联合免疫缺陷病(SCID)小鼠的关节内局部注射F
ADD腺病毒(Ad-F
ADD),可以通过诱导凋亡消除滑膜细胞。而且这种凋亡只限于滑膜组织而不影响软骨细胞。
将抗关节炎基因导入脾细胞的实验带来了成功的结果。在这个实验系统中,具有
胶原诱导关节炎的小鼠其脾细胞被用来将基因导入SCID小鼠中。使用编码S肿瘤坏死因子
RI和转移生长因子β1(TGF-β1)基因的实验取得了较好的结果。
在RA动物模型实验中,将编码s肿瘤坏死因子R和vIL-10的腺病毒载体系统性导入也显示了改善关节炎的能力。尽管几天后,在外周循环中就已经检测不到转基因产物,其抗关节炎的效果可以持续更长时间。在这种情况下,值得注意的是,为产生显著的抗关节炎作用所需要注射的腺病毒载体的数量接近于产生严重肝炎的数量。
另一种方法是肌注编码抗关节炎蛋白的裸D
NA。尽管通过这种途径基因表达的水平不高,但是基因表达持续的时间较长。最近报道,通过肌注编码TGF-β的cD
NA可以减轻鼠的链球菌细胞壁诱导的关节炎的病情活动性。在鼠足垫中注射编码IL-10的cD
NA也可以抑制
胶原诱导的关节炎。
已经在动物模型中试验过的抗关节炎蛋白质有:IL-1Ra、s肿瘤坏死因子-R、TGF-β1、vIL-10、sIL-1R、FasL、IL-13和IL-4。在将人类RA滑膜细胞和正常软骨细胞移植到SCID小鼠的模型中发现,滑膜细胞使软骨退变有两种机制:一种是滑膜细胞直接侵蚀,另一种是滑膜细胞激活软骨细胞介导的软骨溶解。使用反转录病毒将IL-1Ra的cD
NA导入其中,可以抑制软骨细胞介导的软骨溶解,不影响滑膜的侵蚀。而将IL-10或vIL-10基因导入将抑制滑膜细胞对软骨的侵蚀,不影响软骨细胞介导的软骨溶解。
在1996年,FDA批准了第1个基因治疗的人体研究。参加研究的对象为9例患有RA的绝经后妇女,她们都准备进行数个MCP关节的全关节置换手术。第1次手术从她们关节中得到各自的滑膜组织,从中提取出成纤维细胞并在体外培养。这些细胞被分成两组,一组被逆转入IL-1Ra cD
NA,另一组保持原样。在经过安全测试后,分别将这些细胞注射到原先患者的MCP关节内,每个患者都有2个关节注射处理过的成纤维细胞,另外2个关节注射没有被转入的成纤维细胞。1周后计划中的第2次手术分别取出关节内的滑膜组织。体外分析表明,滑膜组织中成功地进行了基因转移和表达,在关节内基因的产物具有生物学活性。由于试验的时间很短,临床上并没有产生关节炎症状的改善。
基于目前所得到的实验结果,RA的基因治疗有着广阔的前景。随着实验技术的进步,在不久的将来可望用于临床。
(2)造血干细胞移植治疗:尽管RA是一种自身免疫疾病,在某种程度上,它可以被看作似于恶性淋巴增殖性疾病。恶性疾病的标志是:丧失生长抑制、原癌基因突变和克隆增殖。来自于RA患者的滑膜细胞中的成纤维样细胞,在体外可以自主增殖,体内这种行为导致软骨的破坏。细胞逃脱生长抑制的可能机制是原癌基因的突变。在RA患者受累关节的滑膜细胞中可以发现p53原癌基因的突变。B淋巴细胞免疫球蛋白和T细胞受体的偏移(skewing)提示,在RA受累关节滑膜内有B细胞和T细胞的克隆扩增。RA和恶性疾病一样,也能带来严重的致残和疼痛,缩短预期寿命。基于以上的原因,最早用于治疗血液系统恶性肿瘤的造血干细胞移植(hemopoietic stem cell transplantation,HSCT)自然被设想可以用于治疗RA。
在对再生障碍性贫血的患者使用异体造血干细胞移植(allo-HSCT)治疗后发现,那些合并RA的病人其RA症状也得到了缓解。一共有8例再生障碍性贫血合并RA的患者,他们在移植后都得到了缓解,有3例分别在移植后58天、75天和93天后因GVHD而死亡,1例在2年后RA症状复发,1例缓解超过2年,1例缓解超过6年,1例缓解超过8年,1例最初减轻,然后病情缓解超过11年,移植成功者的生存期都在10年以上。Allo-HIST的基本原理是改变受体对疾病的基因易感性,提供异体基因移植物以产生移植物抗自身免疫效应(graft versus autoimmunity,GVA)。因此,即便宿主体内仍然存在RA的病因,使用供体的造血干细胞替代受体的易感性干细胞可以防止疾病的发生。由活性细胞介导的GVA效应可能来自于成熟的供体淋巴细胞对受体自身反应性细胞的消除、调节和诱导凋亡。临床上这种效应最近被报道。尽管理论上这种GVA效应是有益的,allo-HSCT最显著的毒性是供体细胞对受体正常组织的免疫反应,即移植物抗宿主反应(graft-versus-host disease,GVHD)。与自体造血干细胞移植相比,allo-HSCT具有较高的发病率(morbidity)和病死率(mortality),主要与GVHD有关。另一方面,最近报道可以使用比较安全的非骨髓清除性干细胞移植(non-myeloablative stem cell transplant)代替危险的骨髓清除性预处理(myeloablative conditioning),即所谓袖珍异体移植(mini-allografting),例如,在预处理时使用环磷酰胺或fludarabine等。已经证实,通过免疫抑制而不是骨髓清除性预处理也可以充分而迅速地完成供体造血干细胞的嫁接(ingraftment)和受体所有造血干细胞的相应清除,这样就减少了与移植程序相关的毒性和病死率。但GVHD仍然是影响allo-HSCT安全性的主要障碍。对异体移植物的淋巴清除(CD34 富集)可以显著减少GVHD的危险性,但同时移植失败率增加。移植成功与否受预处理的化疗强度、输入的供体干细胞数目和促使嫁接的T细胞数目的影响。目前认为,allo-HSCT对于RA来说是一种可治愈(curative)的方法,但是其缺点是程序相关性发病率和病死率较高。怎么设计出一种方案可以将发病率和病死率减少到最小是需要解决的一个问题。
ALAN TYNDALL统计,到2001年5月为止,EBMT/EULAR数据库中使用自体外周血干细胞移植(auto-PBSCT)治疗自身免疫性疾病的共350例,其中RA 43例。这43例中,除去1例动员失败,其余均接受了移植。移植后1例死亡,得到随访的是39例,平均随访时间为11个月。其中13例好转,1例病情稳定,18例最初病情好转但10个月后症状复发,7例恶化。接受auto-PBSCT的患者中,一半使用环磷酰胺 G-CSF动员,另一半仅仅使用G-CSF动员,后者在动员期间病情有轻到中度的活动,但是容易控制。大部分在预处理时都使用环磷酰胺200mg/kg,有3例加上了抗胸腺球蛋白(ATG),另外2例使用
白消安(busulfan) 环磷酰胺,1例使用fludarabine ATG。死亡病例发生在
白消安 环磷酰胺组,复发的病例中大部分使用单个DMARDs(甲氨蝶呤、CsA或来氟米特)就能得到良好的反应,而在移植前这种效果不可能达到。一般说来,患者对auto-PBSCT的程序耐受性较好,移植相关性病死率较低。移植后症状即刻就可以缓解,患者关节痛消失,如扣纽扣和梳头等日常生活的能力很快恢复正常。晨僵缓解,类风湿结节消失,ESR恢复正常,类风湿因子消失。尽管研究表明治疗后症状可以显著改善(达到ACR50或70),但完全缓解不是很常见,并且有一半以上的患者会在2年内复发。移植后症状缓解的时间似乎与预处理的强度有关系,对比试验发现,使用环磷酰胺 100mg/kg的患者反应持续时间是1~2个月,而使用环磷酰胺 200mg/kg者反应时间长达18~20个月。这提示使用更强的预处理方案可能带来移植后更长时间的缓解,但移植相关性病死率也可能会随之增加。对于那些复发的患者,使用移植前效果欠佳的DMARDs大多能获得症状的控制,并且可以作用较长时间。这表明尽管auto-PBSCT不是一个治愈的方法,但可以对病程产生免疫调节作用,而且可以持续较长的时间。
选择什么样的病人进行HSCT还没有严格的规定。从风湿病的角度来看,最理想的病人应该具有下面几个特点:①容易进展到严重的病态和死亡;②对传统的药物治疗无效或被预计到无效;③处于病程早期,没有出现不可逆的脏器损害;④有证据表明,任何已经存在的关节组织破坏为可逆性。但是RA的临床病程很难预计,对具体的病人而言,在病程早期准确地评价预后非常困难。理想的方法是综合临床、基因和实验室标记物来区分预后差的患者。现在已知的是具有DRβ1亚型标记物的患者容易发生骨关节破坏,对药物治疗的反应也相对较差,但这种方法还未应用于临床。目前一个进退两难的局面是,最有希望在移植后获得缓解的患者是那些处于病程早期的,而现在进行HSCT的优先对象是那些病程进展迅速和病变可逆希望较小的患者。如同HSCT治疗恶性肿瘤的早期试验一样,将患者的选择局限于那些病情严重且传统治疗方法失败的病人身上,其结果同样也是治疗反应不佳而且副作用巨大。因为HSCT治疗RA尚处于摸索阶段,目前患者选择的标准也只是各家经验之谈,还需要将来的工作使之不断完善(表39)。
10.中医治疗
(1)辨证论治:本病临床上大致分为活动期和缓解期。活动期多以急性发作或慢性活动、复发等形式出现。病位在表,症状表现以邪实为主。缓解期即是稳定状态、相对静止阶段。病位在里,临床以正虚为主或正虚邪恋。急性发作经过治疗后,可转入缓解期,病情相对稳定,或关节已变形,或不痛不肿,寒热不甚明显。临床中常见发作与缓解交替出现,病情日益加重,以致虚实互见,寒热错杂,给辨证用药带来困难。
根据本病本虚标实、虚实夹杂的病机特点,早期、中期以邪实为主,祛邪时分别运用疏风散寒,清热利湿,行气活血等法;晚期邪实正虚并见,治以标本兼顾,扶正祛邪,分别选用调补肝肾,益气活血,健脾益胃等法。
①正虚:
A.气血两损:
主症:形体消瘦,关节变形,肌肉萎缩,骨节烦疼,僵硬,关节功能4级,筋脉拘急,或筋惕肉
,常伴见腰膝酸软无力、眩晕、心悸、气短、指甲淡白,脉细弱,舌苔薄,舌淡无华,或舌淡红。
治法:益肝肾,补气血。
方药:十全大补汤合独活寄生汤加减。
党参15g,独活10g,桑寄生30g,秦艽10g,防风10g,细辛5g,当归10g,芍药10g,川芎10g,地黄10g,杜仲15g,牛膝15g,茯苓15g,黄芪15g,白术10g,肉桂3g,甘草5g。
分析:方中十全大补汤益气补血以扶正;独活、秦艽、防风祛风湿止痹痛;配以杜仲、牛膝、桑寄生既能补肝肾以壮气血生化之源,又可壮筋骨以除顽痹;细辛发散风寒,通经活络。诸药合用共奏益气养血,扶正祛邪之功。
加减:偏阴血虚者,咽干耳鸣,失眠多梦,盗汗,烦热,颧红,加
左归丸治之。偏阳虚者,面咣白,浮肿,畏寒喜温,手足不温,加
右归丸治之。肿胀甚者加白芥子、皂角,外敷皮硝。关节疼痛甚者,宜于石楠叶、老颧草、岗稔根、忍冬藤、虎杖、金雀根等药中选择应用。由于病痼日久,非草木之品所能奏效,参以血肉有情之物如祁蛇、乌梢蛇、白花蛇等外达肌肤,内走脏腑之截风要药,及虫蚁搜剔之类药,皆可酌情选用。
B.肝肾阴虚:
主症:关节疼痛长期反复发作之后,关节拘挛不利,局部常有轻度的灼热红肿,疼痛多以夜间明显,或无明显关节局部症状。同时有头晕目眩,耳呜咽干,心烦,手足心热,夜寐不安,腰膝酸软,脉细数,舌光红。此型见于RA慢性期。
治法:滋阴补肾,养血和血,畅筋骨、利关节。
地黄20g,枸杞子10g,山茱萸10g,龗板胶10g(烊化),鹿角胶10g(烊化),菟丝子30g,怀牛膝15g,狗脊15g,桑寄生30g,当归10g。
分析:方中地黄、枸杞子、山茱萸、龗板胶填补真阴,育阴潜阳;配菟丝子、鹿角胶峻补精血,配牛膝、桑寄生、狗脊补肾壮腰,当归养血活血,共奏滋补肝肾、填精益髓、强壮筋骨之效。
加减:若病程较长,反复治疗仍腰痛不止者,多挟瘀阻络,加乌梢蛇30g,
丹参20g,地龙10g;挟风湿者,出现关节疼痛、重着,加防己15g,秦艽15g,威灵仙10g;挟湿热者舌苔黄腻,加炒薏苡仁20g,土茯苓15g,木瓜10g,以清利湿热,通络止痛;阴虚内热甚者,用生地黄30g,加女贞子10g,旱莲草15g。
C.肝肾阳虚:
主症:关节冷痛、肿胀,昼轻夜重,屈伸不利,腰膝酸软无力,足跟疼痛,畏寒喜暖,手足不温,面色咣白,自汗,口淡不渴,毛发脱落或早白,齿松或脱落,或面浮肢肿,或小便频数,男子阳痿,女子月经后衍量少,舌质淡胖嫩,舌苔白滑,脉沉弦无力。
治法:温补肝肾,祛寒除湿,散风通络。
方药:附子汤加减。
附子9g,防风12g,独活15g,细辛3g,革薜20g,山茱萸12g,牛膝15g,肉桂6g,川芎12g,当归12g,黄芪30g,白术20g,石菖蒲12g,枳壳9g,菊花9g,天麻9g,生姜5g。
分析:方中附子大辛大热,温阳散寒疗痹为君药;防风、独活、细辛、萆薜祛风散寒除湿,山茱萸、牛膝、肉桂益肾温阳,共为臣药;川芎、当归活血通络,黄芪、白术、枳壳补气行气,石菖蒲芳香性温祛湿通窍,菊花清利头目,天麻祛风通络,共为佐药;生姜辛温发散,散寒通络为使药。
加减:若气虚者加党参、冬虫夏草;若痰湿重者酌加南星、白芥子、薏苡仁;若瘀血痛者加土鳖虫、制乳香、制没药;若阴虚者加生地、石斛等。
D.脾肾阳虚:
主症:骨节僵硬,屈伸不利,关节怕冷,畏寒喜暖,手足不温,腰膝酸软,口淡不渴,或面浮肢肿,纳差腹胀,小便频数,大便稀溏,或男子阳痿,女子带下清稀,舌淡胖,舌苔白滑,脉沉迟无力。
治法:温补脾肾,通阳蠲痹。
方药:温阳通痹汤。
黄芪18g,白术12g,熟附子12g,肉桂5g(研末),当归15g,熟地15g,小茴香10g,杜仲15g,独活12g,豨莶草15g,蜈蚣2条,炙甘草6g。
分析:方中以熟附子、肉桂温阳,黄芪、白术益气,当归、熟地养血活血,小茴香、蜈蚣温经通络,独活、豨莶草祛风除湿,杜仲益肾除湿,甘草调和诸药。全方共奏温补脾肾,通阳蠲痹之功。
②邪实:
A.风寒湿痹:
主症:关节剧痛,不可屈伸,甚至强直拘急,时轻时重,遇寒加重,得热缓解,每遇阴雨天加重。舌苔薄白,脉弦紧或濡缓。
治法:温阳祛寒止痛,除湿通痹。
方药:乌头汤合薏苡仁汤加减。
分析:方中麻黄发汗开表,散寒行痹,乌头搜风散寒,温经止痛;黄芪益卫气;芍药理血痹;甘草和诸药;煎加蜂蜜,既益血养筋,缓急止痛,又可制乌头燥热之毒。薏苡仁、苍术除湿通痹;白芍、甘草止挛急疼痛;川芎、当归调气血。乌头为大辛大热的毒药,开始用量要小,若药力不足时,可酌情加大,但必须煎熬时间要长,以防中毒。
加减:关节肿大、湿盛者,用五积散;瘀滞者,酌加桃仁、红花、穿山甲,配合大
活络丸口服。
B.风湿热痹:
主症:见于本病急性活动期。关节肿痛,局部灼热发红,或兼发热,汗出恶风,口渴,小便短赤,舌红、苔淡黄,脉滑数或濡数。
治法:清热利湿,祛风通络。
方药:白虎加桂枝汤化裁。
生石膏15~30g(先煎),知母、黄柏、桂枝、苍术各10g,粳米15g,胆南星、甘草、羌活、防风各6g,海桐皮、鸡血藤各12g。
C.毒热痹:
主症:关节红肿,掀热跳痛,不可触近,更不能转侧,皮下红斑,发热寒战,心烦,口渴,溲黄、大便干,舌苔黄,脉弦滑数。此证多为RA急性发作期表现。
治法:清热解毒、活血、凉血通痹。
方药:四妙勇安汤加味。
分析:方中玄参、生地、金银花、生甘草、
毛冬青、白花蛇舌草有清热解毒、凉血止痛之功;当归、赤芍、牛膝有活血祛瘀之力。以上诸药对类风湿脉管炎治疗有较好的效果,再加萆薜、薏苡仁、老鹳草除湿利关节以助消肿止痛、恢复关节活动之功。
D.寒热错杂证:
主症:多见于本病急性期向稳定期过渡阶段,关节冷痛或关节灼热疼痛,舌质淡红,舌苔薄白或黄,脉弦数或缓。
治法:清热散寒,通经活络。
方药:桂枝芍药知母汤加减。
桂枝、麻黄、制附子各6g,赤白芍、白术、防风、知母、黑料豆各12g,全蝎4.5g,制乳香、制没药、苏木各10g。
③痰瘀:
A.痰瘀互结:
主症:关节肿痛且变形,活动时痛,屈伸受限,肌肉刺痛,痛处不移,皮肤失去弹性,按之稍硬,肌肤紫黯,面色黧黑,或有皮下结节,或肢体顽麻,眼睑浮肿,舌质暗红或有瘀斑、瘀点,舌苔薄白,脉弦涩。
治法:活血化瘀,祛痰除胀。
当归10g,秦艽10g,桃仁10g,红花10g,香附10g,地龙10g,五灵脂10g,没药10g,羌活15g,川芎10g,牛膝30g,甘草5g,制半夏10g,枳壳10g。
加减:伴见血管炎、脉管炎患者,合四妙勇安汤(元参、金银花、当归、甘草)以清热解毒,活血养阴,量大力专。痛剧加制乳香、延胡索、地鳖虫。臂肘肿胀者,多为淋巴回流阻塞,加莪术,或
指迷茯苓丸配以水蛭、泽兰、蜈蚣。
B.气血两虚,痰瘀互结:
主症:见于本病后期关节僵硬变形阶段。关节疼痛,肿胀变形,活动不利,面色咣白,心悸气短,身疲困倦,舌质淡红,舌苔白,脉沉细弦紧。
治法:益气养血,化痰祛瘀,通经活络。
方药:当归拈痛汤加减。
当归、白术、党参、苍术、干葛根各10g,黄芪、茯苓、泽泻、猪苓、
丹参各12g,羌活、
黄芩、升麻、防风各6g,桂枝、甘草各4.5g。
C.肝肾亏损,痰瘀互结:
主症:见于本病后期,特别是长期使用激素类药物的患者,关节肿痛,变形,肌肉消瘦,屈伸不利,腰膝酸软,关节局部发热,头晕耳鸣,失眠盗汗,舌质红,少苔,脉细数。
治法:滋补肝肾,化瘀活血,搜风通络。
方药:五味子汤加减。
五味子、制附块、姜黄、地龙各6g,巴戟天、山萸肉、熟地、炒杜仲、仙灵脾、金毛狗脊各12g,牛膝、黄芪各10g,乌蛇、蜂房各4.5g。
加减:风邪偏胜的加秦艽、威灵仙,重用防风;寒邪偏盛加细辛、麻黄;湿邪偏盛加防己、蚕沙、五加皮;气血亏损加首乌、党参;热邪偏重加生石膏、土茯苓。
中医证型是一个动态的过程,一个证型可以出现病程的不同期,虽然肝肾两虚及肾阳虚多出现在中后期,但在急性发作时又可以热毒或寒湿为突出表现,即虚实相夹,因此,不仅其证型,不是一成不变,而且一个证型在不同时期可以夹有其他兼症,如血瘀痰阻,这在临床辨证施治时应根据当时具体情况辨证用药。
(2)综合治疗:
②单验方:
A.鲜生地90g,水煎服,服3天停3天。治关节红肿热痛,降血沉。除大便稀外,别无副作用。
B.虎杖根250g,洗净切碎,浸白酒0.75kg,泡半月后,每次20ml,2次/d。
C.15%雷公藤酊:每次10~15ml,3次/d;少数不能饮酒者,用去皮雷公藤生药20g,水煎2h,饭后口服。
D.闹羊花侧根药蛋:鲜闹羊花侧根500~600g,牛膝60~90g,甘草60~90g,或加竹鞭笋60g,鸡蛋10个。先将蛋煮熟去壳,放入药物中文火熬6天6夜,待蛋白变黑;蛋黄微黑即可。每天早饭后蒸服1只蛋,10天为1个疗程。疗程间隔7天,轻者服3~4个疗程,重者服至9个疗程。
③针灸疗法:
A.毫针:辨证取穴:行痹取膈俞、风门、血海;痛痹取肾俞、关元;着痹取脾俞、阴陵泉、商丘、三阴交;热痹取大椎、曲池、合谷、昆仑。局部取穴:肩部取肩髑、肩髎、曲池、外关;肘部取曲池、尺泽、手三里、外关、合谷;髋部取环跳、秩边、次髎、委中、风市、阳陵泉;膝部取梁丘、犊鼻、膝眼、鹤顶、阳陵泉、足三里;踝部取悬钟、申脉、照海、昆仑、丘墟。方法:平补平泻法,针刺得气后留针30min,1~2天1次。或适当加用低频脉冲电流10min。
B.灸法:取阿是穴(病变局部)、大椎、肩髑、曲池、合谷、风市、足三里、三阴交、绝骨、身柱、腰阳关、肾俞、气海。方法:每次选4~6穴,施艾卷温和灸,每穴施灸10~20min,1~2次/d。
C.刺血:根据疼痛部位,按经络循行,在局部取1~2个阿是穴和病灶局部周围处。方法:阿是穴用散刺放血法,病灶局部周围处用围刺放血。均用梅花针重叩刺(叩刺范围略大于火罐口)至皮肤出血后,或用三棱针点刺放血。针后拔罐。关节炎用闪罐法,脊背痛用走罐法。隔天1次,5次为1个疗程。
D.皮肤针:阿是穴(压痛点)及受累关节周围和有关穴位采用重刺法。按病变部位取穴施治,如膝关节疼痛,可选取足阳明胃经和足太阴脾经叩打,以后再重点叩打梁丘、犊鼻、阳陵泉、膝阳关和阿是穴。方法:一是循经叩打,沿经络循行,由肢体远端向近端,或由近端向远端叩打后,在皮肤上可出现和经络走行一致的红线(皮肤小出血点);二是重点穴位叩打,即重点叩打受累关节周围的穴位,阿是穴为疼痛严重或敏感的部位。每天叩打1次。疗程与病程久暂有关。
E.钩针:以取病变关节局部的穴位和阿是穴为主,并可根据经络辨证、循经取穴。常规消毒局部后,左手固定穴位,顺手持针,快速刺入皮下,再加压进针到病所,先进行弹拨,后进行松解、分离,同时借锋钩针有规律的前进后退动作,牵拉勾割粘连的软组织,也可视病情进行周围的牵拉剥离性操作,每个方向动作2~3次即可,待局部有明显热感、胀感等得气感时出针,并用棉球压迫防止出血。隔天1次,10次为1个疗程。一般连续治疗3个疗程以后,就可收到明显效果。
F.头针:取额顶带后1/3、顶颞前斜带或顶颞后斜带(对侧相应部位)、额中带,用小幅度提插泻法。额顶带后1/3宜由前向后刺,顶颞前斜带或顶颞后斜带(对侧相应部位)宜沿带接力透刺,额中带宜由上向下刺。在行针时,宜嘱患者吸气、憋气,意想气至病所,并做患部肢体活动或按揉。每次行针3~5min,间隔15min再行针1次,留针2~4h,1次/d,7~10次为1个疗程。临床若属风、湿、寒痹者,可采用治疗带灸法与按摩法。头皮针对本病有一定疗效。在RA的急性活动期应适当掌握运动量,不可太大或过于激烈,在缓解期及平时留针期间宜坚持肢体活动,以利于肢体的恢复。对慢性RA,可隔天治疗1次,并可加用灸法,坚持数个疗程。
此外,还有耳针、自血、水针刀、埋线、刮痧等疗法。
④推拿疗法:早期以和营通络、滑利关节为原则,后期骨性强直者以舒筋通络,活血止痛为原则。
A.上肢部:a.患者坐势,医者站于一侧,一脚踩凳上,将患肢搁在大腿上,用
法在手臂内、外侧施治,从腕部到肩部,上下往返。同时适当配合各关节的被动活动。b.接上势,从肩部到腕部,上下往返用拿法,重点在肩、肘、腕部配合按揉肩髑、肩贞、肩髎、曲池、尺泽、手三里、合谷、阳池、大陵。c.患者坐势,医者坐于前侧。捻、揉腕部及各掌指和指间关节,同时配合适度的摇法。然后再摇肩、肘关节,搓上肢4~5次。
B.下肢部:a.患者俯卧位,医者站于旁。用
法施于臀部,向下至小腿后侧。髋、膝、踝关节后面作重点治疗,同时配合髋后伸、外展及膝关节的伸屈被动活动。然后按环跳、居髎、委中、承山。b.患者仰卧位。医者站于旁,用撩法施于大腿前部及内外侧,向下至小腿外侧,沿阳陵泉、足三里穴向下到踝部,同时配合髋关节的外展、外旋被动活动。c.接上势。在膝关节周围用
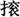
法治疗,同时配合按揉膝眼。d.接上势。在踝关节周围及足背用
法治疗,同时配合踝关节屈伸及内、外翻活动。再捻摇足趾和摇踝关节。然后拿委中,沿小腿后侧向下到跟腱4~5次。最后搓下肢,从大腿到小腿。不论上肢或下肢,病变较重的关节,均可加用擦法和热敷,对提高疗效有一定帮助。
⑤其他传统疗法:砂浴、坎离砂、湿泥、敷贴、麝火、药棒、握球等。
(3)治疗方案实施:目前RA尚无特异治疗药物,各种药物仅在不同的情况下有效,而且,各类药物的治疗机理亦不同,故对一个具体的RA患者,多主张联合用药治疗。西医曾有过“金字塔”方案,采用所谓上台阶式,即先用消炎镇痛药,半年无效再逐一加改变病情的抗风湿药,如金制剂、青霉胺,无效再加细胞毒药,最后加用糖皮质激素。这种方式的最大缺点是使用消炎镇痛药半年无效者,骨质已被破坏,再用改变病情药物,对已造成的破坏已无法恢复。另一种为下台阶式,即先联合多种药,以后逐渐分别停用,最后仅留一两种副作用最小的药物维持。对这些方案,尚难作出评价,目前也还没有完美的模式。
美国风湿病学会在其权威性杂志《关节炎与风湿病》上发表了2002版新修订的类风湿关节炎治疗指南,指出:循证医学证实,缓解病情的抗风湿药能改善病情并延缓骨关节破坏(经影像学证实),因此任何确诊为类风湿关节炎的患者,如果具有进行性关节疼痛、明显晨僵或疲劳、活动性滑膜炎、血沉和C-反应蛋白水平持续升高或影像学证实有骨关节破坏,不论使用非甾体类抗炎药是否能充分缓解症状,都应在确诊后3个月之内应开始应用缓解病情的抗风湿药治疗。常用的包括
羟氯喹、柳氮磺吡啶、甲氨蝶呤、来氟米特以及肿瘤坏死因子拮抗剂
依他普特和infliximab。较少使用的有硫唑嘌呤、青霉胺、金盐、米诺环素以及环孢素。新的治疗指南推荐缓解病情的抗风湿药联合治疗,尤其是甲氨蝶呤加柳氮磺吡啶加
羟氯喹三联方案。新上市的来氟米特以及生物制剂肿瘤坏死因子拮抗剂的治疗前景被看好。口服小剂量糖皮质激素(小于10mg/d,或等效剂量的其他药物),以及局部注射糖皮质激素,对于病情活动的类风湿关节炎患者缓解症状非常有效。新近的研究证据表明,小剂量糖皮质激素能减缓关节破坏的进度,因此糖皮质激素具有缓解病情的潜能。然而,全身使用小剂量糖皮质激素的同时,必须时刻权衡其副作用。接受糖皮质激素治疗的患者应给予钙(1500mg/d,包括饮食和钙制剂)和维生素D(400~800U/d)治疗,应在糖皮质激素治疗开始时给予。另外,采用抑制破骨细胞药,尤其是二磷酸盐制剂,可以阻止骨丢失。对于绝经后妇女可同时给予雌激素替代治疗。对于疼痛无法忍受,关节活动范围受限以及因关节结构破坏导致的功能受限可以考虑手术治疗。类风湿关节炎的外科治疗包括椎管减压术、滑膜切除、趾(指)摘除术、关节成形术以及关节融合等。
根据我国情况,可考虑中西药联合的方案。可在上述西医治疗的基础上,再根据中医辨证,综合治疗,采用适当的方案,可望起到增强疗效、减少副作用的效果。稳定期病人,可用中医辨证施治联合使用改变病情的西药,或仅用中医药辨证治疗。
从战略高度考虑,治疗类风湿关节炎,必须处理好“治标”与“治本”的关系。“治标”即止痛,“治本”即调节机体免疫功能。现在人类对疼痛的解决不但方法多,而且疗效迅速,就连癌性疼痛都能较好的解决。但是止痛药物和方法对类风湿关节炎只能暂时缓解疼痛症状,若停用则疼痛症状重现,若长期使用止痛药物,如非甾体抗炎药及激素等,则会出现胃肠道损伤、肝肾损伤、造血功能抑制等副作用,这些副作用有时比原发病更重,更能影响人体健康。所以,病人在疼痛能够忍受的情况下,应尽量减少用止痛剂。关于免疫功能的调整,目前,人类还没有找到一种药物或方法能在较短时间内使紊乱的机体免疫功能恢复至正常状态,这就是类风湿关节炎尚无灵丹妙药的依据。但是,在长期的临床实践和辛勤的研究中,人们已经发现了不少能对机体的免疫功能发挥良好刺激作用的药物和因素(尽管这些药物和因素对于每个人来说不是恒定的、均一的),可使紊乱的免疫功能逐渐恢复至正常或接近正常或改善,如中医药辨证论治、针灸、良好的精神状态、健康和谐的环境、适宜的运动及食物等。其中的中医药辨证论治较为重要,已经被大多数学者接受,并形成了共识,因为它不但效果确切,而且副作用小或无副作用。这里需要强调两点:一是中医药必须辨证论治,绝不能用一方一药套用所有类风湿病人;二是汤药难煎难吃,不适合现代人长期服用,而本病又必须较长期服药,所以,必须改汤剂为现代易服用的剂型。实践证明,采用以“治本”为主兼“治标”的方法,中西医结合,综合治疗,不少类风湿关节炎的预后还是比较好的。
10.护理
(1)护理问题:疼痛;肿胀;关节变形;皮肤易损;心理调适;无力与倦怠。
(2)护理目标:止痛、减轻病人痛苦;患肢夹板或支具固定,以防止发生关节畸形和病理性脱位;加强营养,提高机体抵抗力;消除悲观情绪,坚持治疗与康复;加强功能锻炼,保持关节活动功能。
(3)护理措施:
①休息与营养:身体和心理上的休息是RA基本治疗的一部分。病人所需要的休息量,视病情而定。当全身多关节均被侵犯时,要完全卧床休息,这样即可对抗炎症,又能让承担重量的关节休息。病情轻微的病人,则每天较常人增加2~4h的休息时间即可。合理的饮食调配,对疾病起主导或辅助作用。应根据病人的消化能力以及疾病的特点,配制适合于病人的饮食,鼓励病人饮食。饮食宜给予高营养,高含维生素、钙、铁及蛋白质的食物,应多样化,保持均衡并富于营养,忌生冷、油腻、辛辣之物。
②心理护理:护理人员应使病人和其家属了解该病的病情及病程,鼓励病人在合理的体能范围内继续工作。同时也应将减轻关节和疼痛、预防关节变形的方法教给病人和家属,使其能适当的使用消炎止痛剂、夹板、物理治疗等控制病情。对病情一时不能控制、情绪急躁、求治心切、需要关心、宽慰的病人,应说明本病具有反复发作的特征,告之只有及时治疗,才能使病情得以控制。患者保持良好的情绪对治疗具有积极意义,鼓励病人以最佳状态配合治疗。
③生活护理:由于疾病的影响,给患者带来诸多不便,需要帮助与指导。每天测体温,及时擦干汗液、勤换衣物、保持床铺整洁干燥,勤洗脚或洗澡,促使血流通畅。对肢体功能丧失卧床不起者,要防止压疮发生。对严重功能障碍者,做好饮食起居的护理,防止跌仆、骨折的发生,避免突然的移动或负重。疼痛剧烈时,可以按摩关节两旁的肌肉,以减轻肌肉痉挛而引起关节疼痛。
(4)适当的姿势与活动,可预防畸形发生:
①病人的姿势:A.卧床休息时,不要将枕头放在病人膝下,而且不应让病人长时间维持于抬高头部和膝部的姿势,以预防病人发生颈部和膝、髋关节的屈曲性挛缩;大多数时间应该仰卧平躺,保持受侵犯关节伸展的姿势;通常会在踝下垫一小枕头以使膝部平直;手臂的姿势应该是掌面向上,可在肘下或腕下垫一小枕头或折叠的毛巾,以维持伸展;对仰卧病人,必要时可以放置砂袋,预防髋关节外翻。B.应经常更换姿势,每天至少应有2~3次俯卧,每次15~30min,以防髋关节发生屈曲性挛缩。C.有时也可以利用夹板或支具固定受侵犯的关节,一方面可使疼痛减轻,另一方面也可以预防或减少畸形发生。D.坐或站立时也应维持直挺姿势。
②活动与运动:见“康复”部分中的“运动疗法”。
(5)合理应用药物:到目前为止,仍没有任何一种药物可以治愈RA,在治疗期间,医生会开给病人各种不同的药物,应该让病人了解,病人最好能和医师共同鉴别哪些药物对病人是最有效的。
(6)冷和热的应用:①用热于关节可使关节疼痛、僵硬和肿胀等症状减轻,也可以使肌肉放松。而且在运动之前先用热,也可以使运动施行起来更方便有效。热的使用通常在急性期过后才施行。常用的热疗方法有很多,例如:利用电热垫、热水袋、石蜡浴和红外线等可供给干热,利用热敷、盆浴、淋浴以及旋涡浴等,可提供湿热。②部分病人的关节疼痛,可以因用冷而获得缓解,在急性期也可以使用。③不论使用热或冷,都应小心,避免皮肤受损伤。
(7)鼓励并训练病人自我照顾:①协助病人学习更有效的日常生活方式,以提高生活质量。②可利用各种不同的自我照顾器具,以协助病人维持最大限度的独立性,例如使用有特殊把手的食具、长柄的梳子和鞋拔、提高座椅和马桶高度等,以使病人能自行进食、梳头、穿鞋和大小便等。③由于疲倦是一常见症状,病人对活动和工作的耐力较低,因此对于病人的自我照顾活动或工作时间应有计划,使其逐渐增加,但应避免产生疲劳感。
(8)出院指导:RA是一种慢性的全身性免疫性疾病,病程长,易反复发作。故对出院回家疗养的病人应做好出院指导等卫生宣教工作。①告诫患者对于各种感染应积极地预防和治疗。②注意防寒、防湿,勿冒雨涉水,久着湿衣。避免在潮湿、寒冷的环境中作息,预防因复感风寒而加重病情。夏季避免游泳,不宜用竹席、空调等,以免诱发关节炎的发作。③宜温性饮食,忌生冷、油腻、辛辣之品。④遵医嘱进行功能锻炼,运动要适当,有条件的
可定期行矿泉浴,以恢复关节功能。⑤遵医嘱用药,不随便停药、换药或增减用量。⑥定期门诊复查。
11.康复
(1)目的与原则:康复治疗主要目的是缓解疼痛,消炎退肿,保持和改善肌力及关节功能,预防及矫正畸形及改善生活自理能力。
为了最大限度恢复患者功能,达到功能的康复,治疗必须多种疗法并进,一方面注意全身营养、药物和物理治疗,另一方面注意防止和矫正畸形,加强功能锻炼,待病变基本控制后,再进行改善功能的治疗,并有完整的治疗计划。不同病期采用不同治疗及康复措施;并对患者及其家属进行有关宣教,以提高治疗信心,取得他们的合作,获得最大康复治疗效果。
(2)方法:
①药物治疗:见“治疗”部分。
②最佳姿势和功能位:由于疼痛性屈肌挛缩导致关节强直,因此要注意保持最佳姿势和功能位,卧床宜用硬板床,枕头宜低或不用,仰卧位时上肢取外旋位,大腿保持中立位。坐位时宜用平板靠背椅,背部挺直靠在椅背上,两脚需平放在地面。
③动静平衡:即不能运动过度而造成不必要的消耗,增加疼痛,又不能完全静止而导致肌肉萎缩和关节挛缩。急性期宜卧床休息,但不宜超过3周。卧床期间经常变换体位,每天取俯卧位1~2h,使躯体和四肢都能得到伸展,并做深呼吸改善心肺功能。关节局部可用夹板作短期制动。
(3)运动疗法:
①水中运动疗法:使患者利用浮力在不负重状态下进行步行训练,利用水的阻力可锻炼患者肌力,在水中变换运动方向及速度,可改变运动方式。水中运动一般无副作用及关节损伤发生。
②关节活动度训练及肌力锻炼可防止及矫正畸形、预防肌萎缩、保持患者功能状态及日常生活活动功能。A.急性期患者的罹患关节应用矫形器、弹簧支架固定,定时脱卸装具进行轻微被动活动,但要防止畸形的加重。B.逐步给以等长练习、等张练习及抗阻训练,在无痛范围内进行。C.每个关节的活动应达到极限,每天训练时要达到关节全范围运动,每天至少1次,但不应引起疼痛加剧。D.一般以每隔1~2h进行短时间的练习(5min或更少)为宜,效果比一般常规较长时间练习更好。E.运动疗法前应先以热疗,如热水浴、红外线或蜡疗。F.必须长期耐心、循序渐进地练习,才能取得效果。G.最好是教会患者一套单独完成或在别人帮助下完成的家庭治疗计划,定期复查并作必要的修改。
(4)物理治疗:
①温热疗法:其作用可镇痛,消除肌痉挛,增加软组织伸展性及增加毛细血管通透性。急性期、有发热不宜使用。其种类如下。A.全身温热:如湿包裹法、温泉疗法、蒸气浴、砂浴、泥疗等,温泉浴是最受患者欢迎的疗法。B.局部温热疗法:如热袋、温浴、蜡疗、红外线、高频电疗法(目前多被微波代替),对全身影响较小。C.电热手套:对患者进行热疗时手套内温度可达40℃,每次30min,2次/d,可减轻疼痛。
②水疗法:常用矿泉浴、盐水浴、硫化氢浴等。急性活动期病人及发热者不宜作全身水疗。
③低中频电疗:如经皮电神经刺激法(TENs)、间动电疗法、干扰电疗法及调制中频正弦电疗法均有很好的镇痛作用,立体干扰电疗法镇痛效果亦佳。
④氢化可的松超声透入治疗:症状体征均有减轻,可降低类风湿活动性,减轻氢化可的松对肝脏的毒性反应。
⑤冷疗法:用于急性炎症期,有镇痛、促进血液循环,减少渗出、消肿、加快局部新陈代谢及增加
胶原纤维弹性,有利于肌肉的伸屈功能锻炼,并能改善关节功能等作用,但有些患者不愿接受此种疗法。
⑥作业治疗及日常生活活动能力训练:关节的伸展与屈曲运动,每天需进行2~3次。如手捏核桃或弹力健身圈,锻炼手指关节功能;两手握转环旋转,锻炼腕关节功能;脚踏自行车,锻炼膝关节功能;滚圆木,踏空缝纫机,锻炼踝关节功能等等。每次活动前局部应先行热敷或理疗如蜡疗、超声波、水疗等,每次活动量要视患者疼痛的耐受程度来决定,活动量应逐步增加,循序渐进,持之以恒。
对日常生活自理能力较差的患者,鼓励其尽量完成日常生活活动训练,如进食、取物、倒水、饮水、梳洗、拧毛巾、穿脱上衣和裤子、解扣、开关抽屉、手表上弦、开关水龙头、坐站、移动、下蹲、步行、上下楼梯、出入浴池等训练。为了达到生活自理,有时需要改装某些生活用具的结构。设计自制一些自动用具,改善生活自理能力。作业疗法除改善患者功能外,还能提高其神经适应能力,是对身心进行的一种综合训练。
⑦其他传统疗法:针灸疗法、推拿疗法及在避免过度负重的情况下进行适度体操和练功,如八段锦、太极拳等。
⑧借助夹板、矫形器等康复:本病可有肢体远端关节变形,如掌指关节尺侧偏位、指间关节的鹅颈变形等、下肢踝关节的外翻和踱屉畸形。采用各种预防畸形的支具(如高分子绷带、石膏夹等),强化病变关节伸肌肌力,对抗屈肌支具、夹板、拐杖、轮椅等的应用能减轻关节畸形发展,缓解疼痛,消肿,防止由于关节不稳定而进一步受损。通常夹板用于腕、掌指关节及指间关节。固定夹板常用于急性期或手术后,应定期卸下作关节活动。
在急性期,固定夹板每
天可上24h,这对不能起床的患者尤为重要,但必须防止压疮形成。当情况改善后,则应缩短夹板固定时间。如类风湿病变侵犯到颈椎,可用软的颈圈将头固定于中间位,在睡眠和活动时(如上街、乘车等)尤为重要。当踝关节和足部亦受累时,可采用矫正鞋以保护足,并早期下床活动。
为了能下床活动,可应用拐杖或助步器来减轻负重和改变重力线。这些设备可保护习惯性负重免于损伤,但可增加上肢受累关节的额外负重。因此,拐杖或助步器上应装有把手,以减少对手、腕、肘或肩部的负重。这些设施要由医师根据患者实际情况作决定。
⑨心理康复:要使患者树立战胜疾病的勇气和信心,保持良好的心理和精神状态,密切配合治疗,达到康复的目的。
⑩手术康复:手术治疗在选择适当指征下,对控制病变,矫正畸形,改善功能起重要作用。常用的手术有滑膜切除术、关节清理术、关节松解术、截骨术、关节融合术、关节成形术、人工关节置换术等。



 流行病学
流行病学
 病因
病因
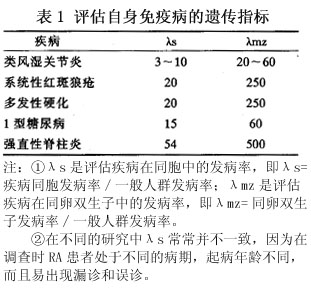
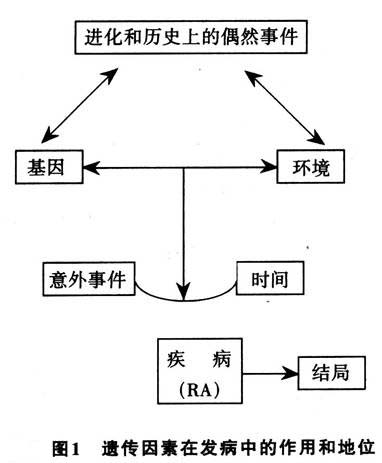
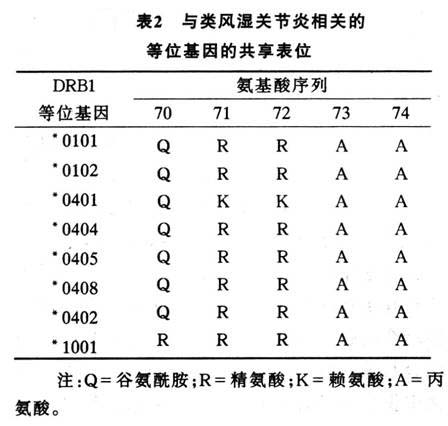




 发病机制
发病机制

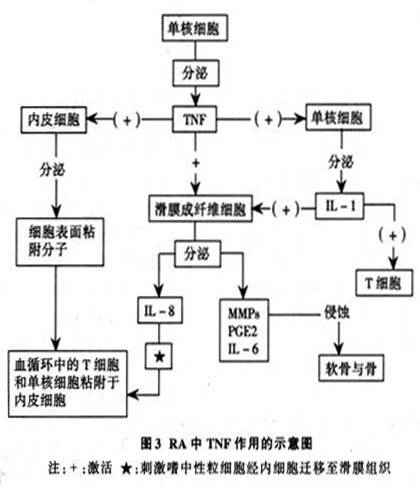
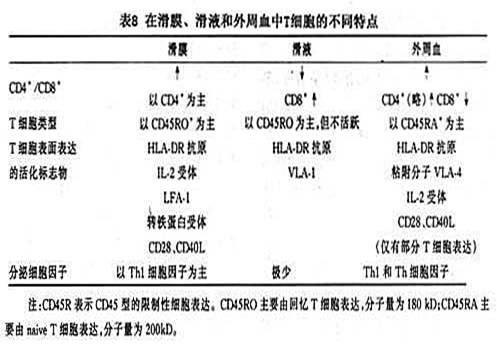


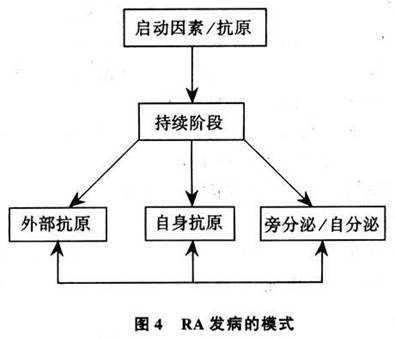

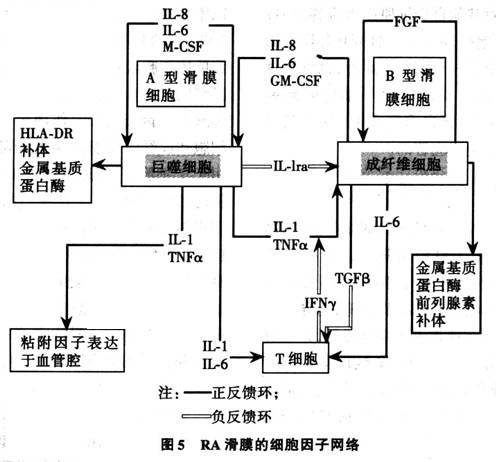




 临床表现
临床表现
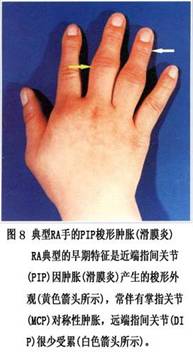
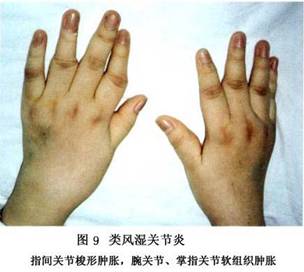
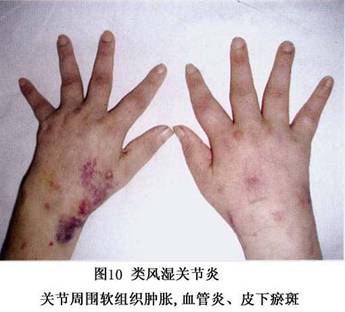
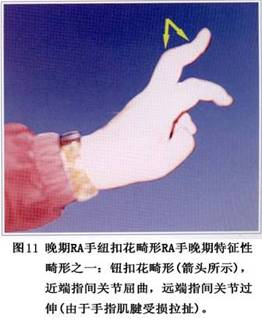
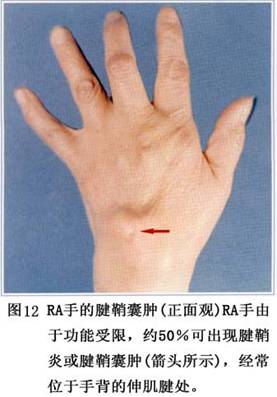
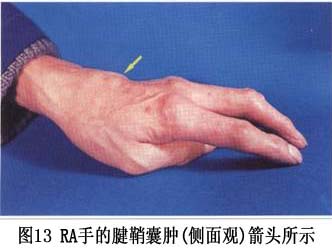
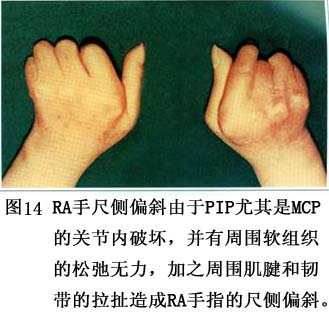
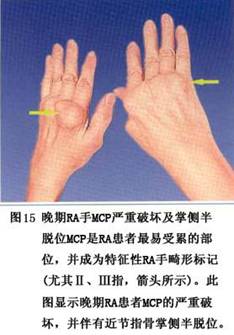
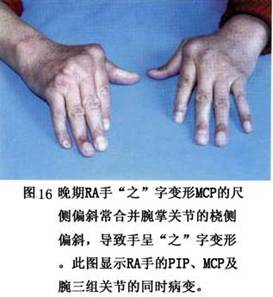

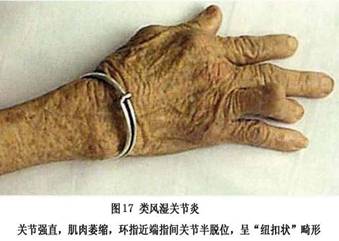
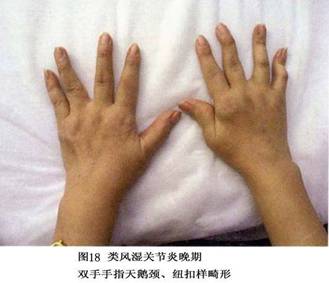
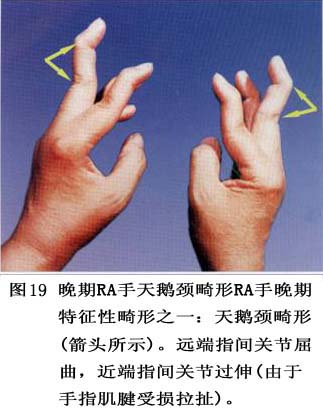
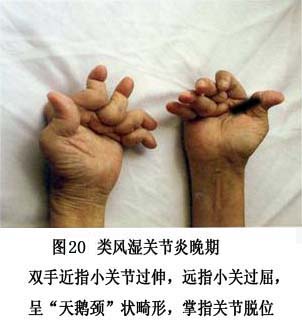
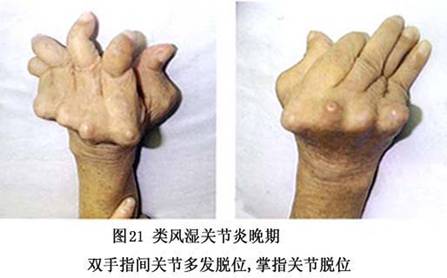
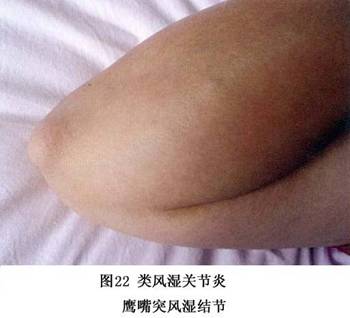
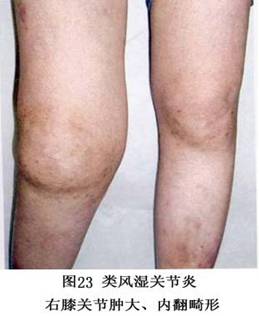
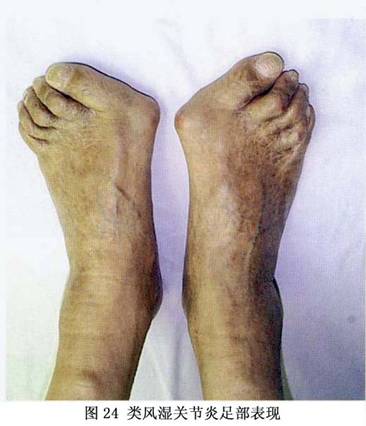

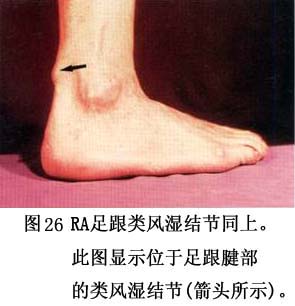

 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
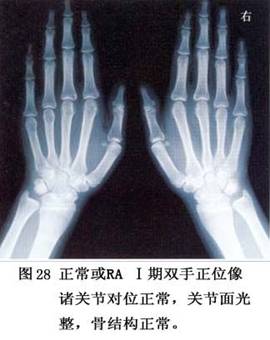
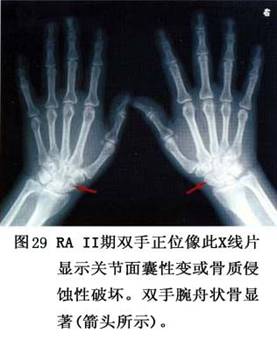
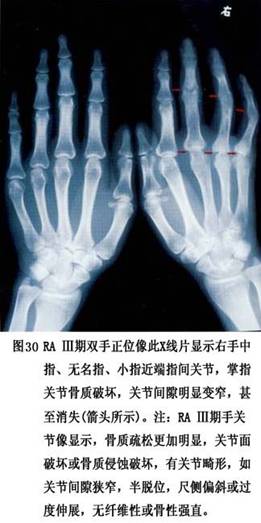
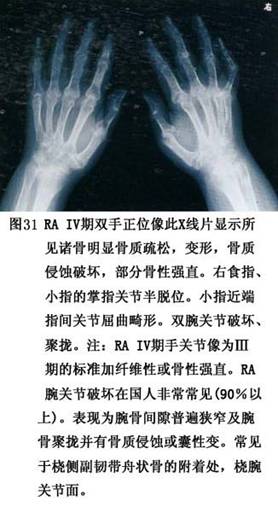
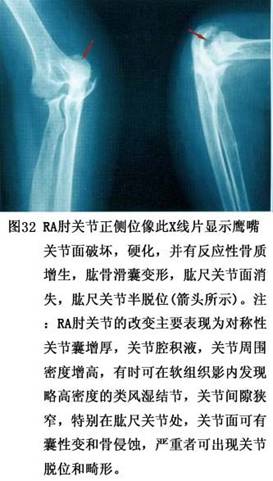
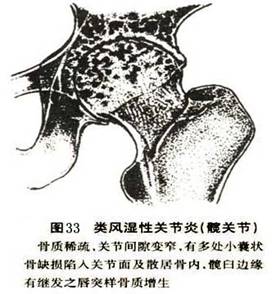
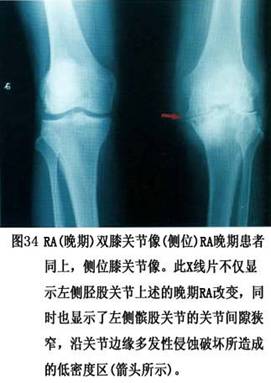
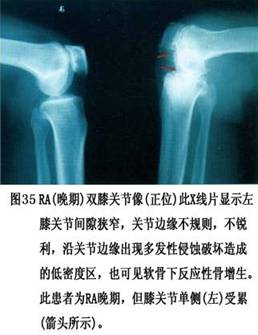
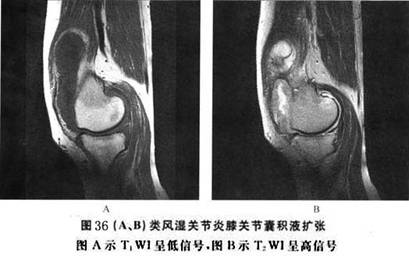
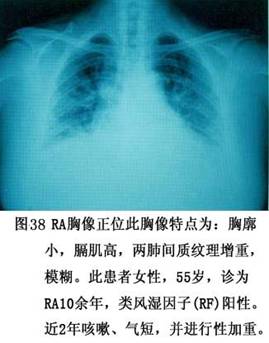
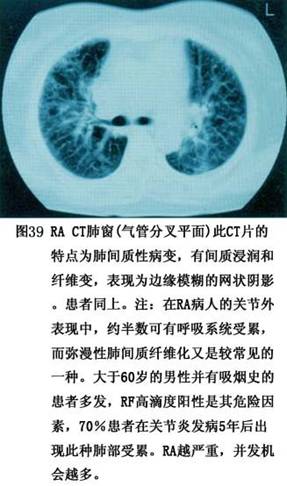
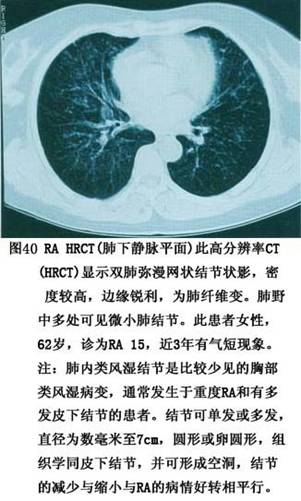
 诊断
诊断
 鉴别诊断
鉴别诊断

 治疗
治疗
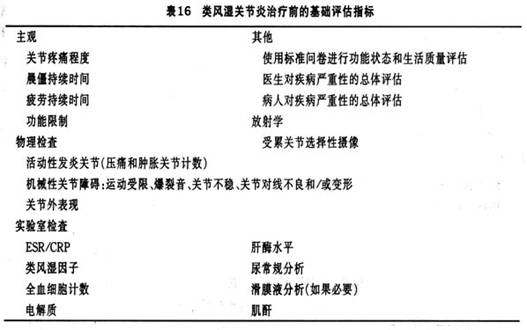



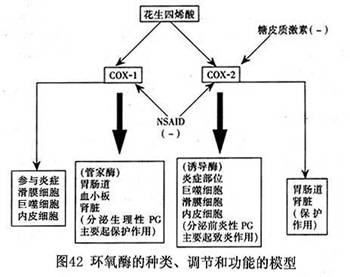
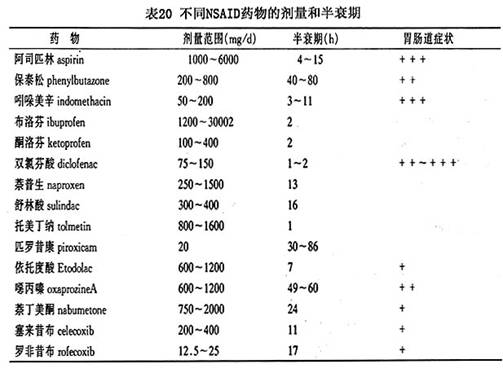

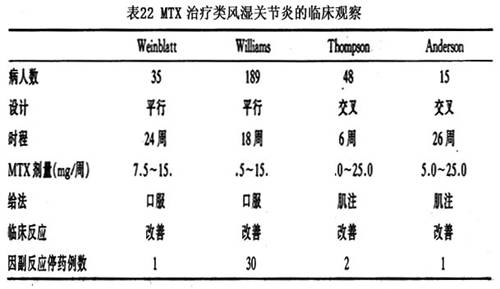
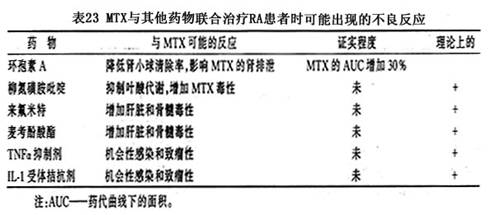












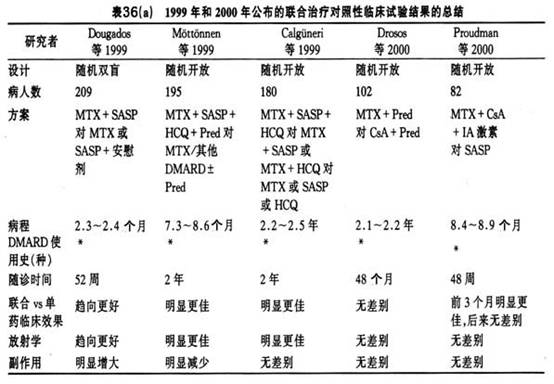

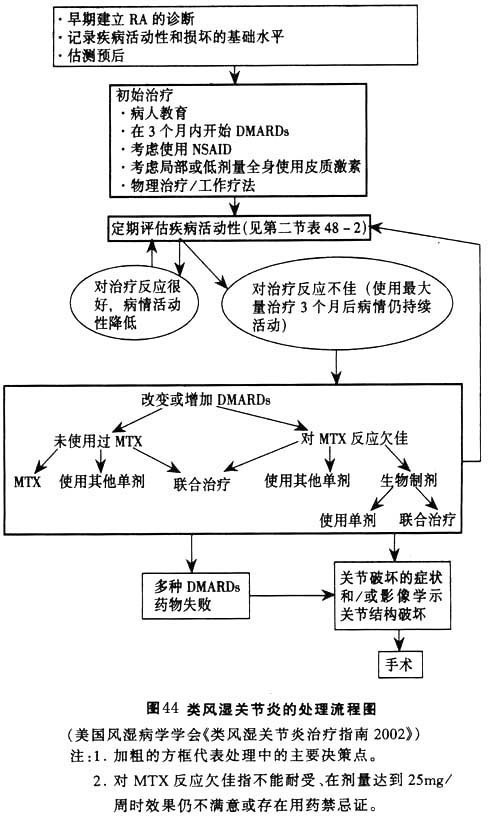
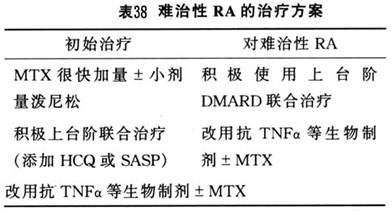

 预后
预后
 预防
预防
